微知识 | 偏振超分辨的用途
| 导语:本文主要介绍偏振超分辨的应用,包括在判断荧光偶极子方位角;微丝、微管的偏振特性;马达蛋白与肌动蛋白相互作用的观察;以及肌动蛋白和血影蛋白在神经中的组装关系等。 |
(一)微丝、微管、DNA的偏振超分辨成像
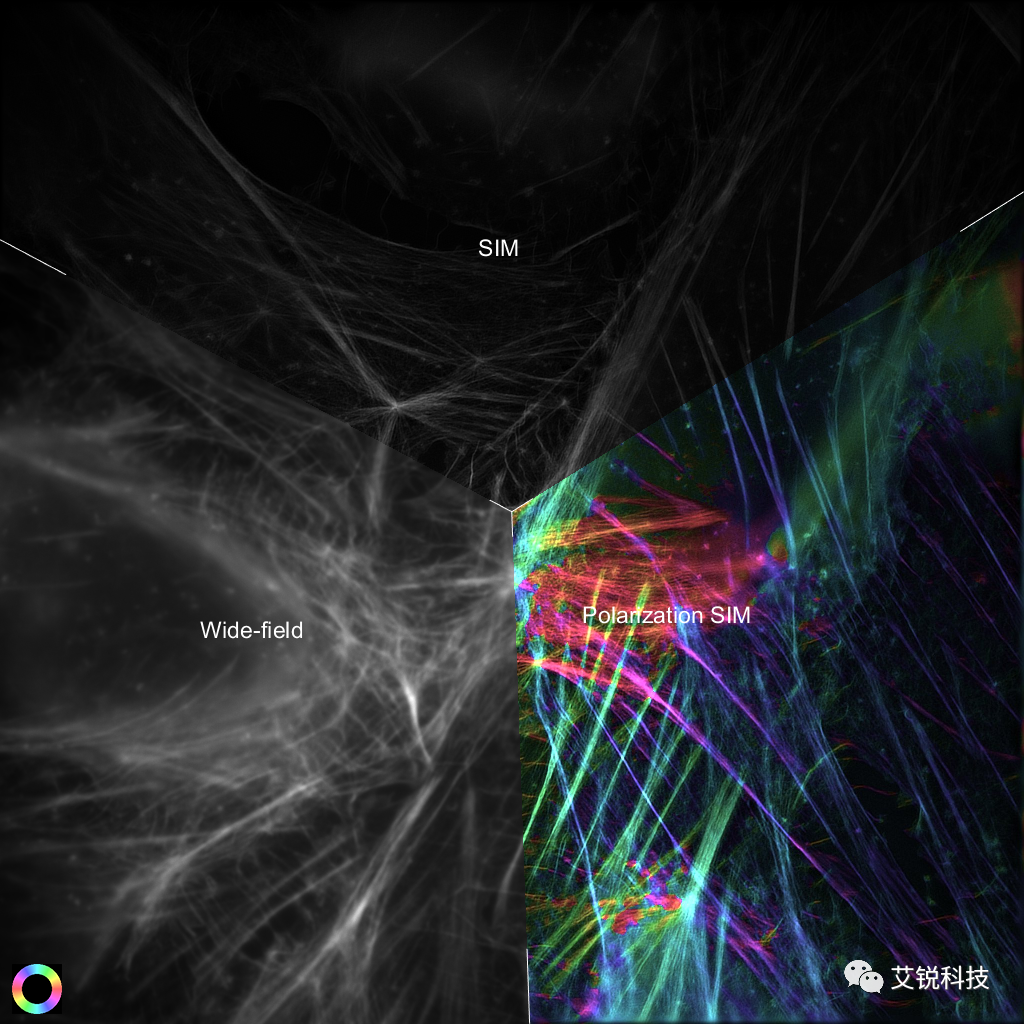
图 1 AF-488染色的微丝结构的WF、SIM、Polar-SIM对比。图像大小:67x67 μm。
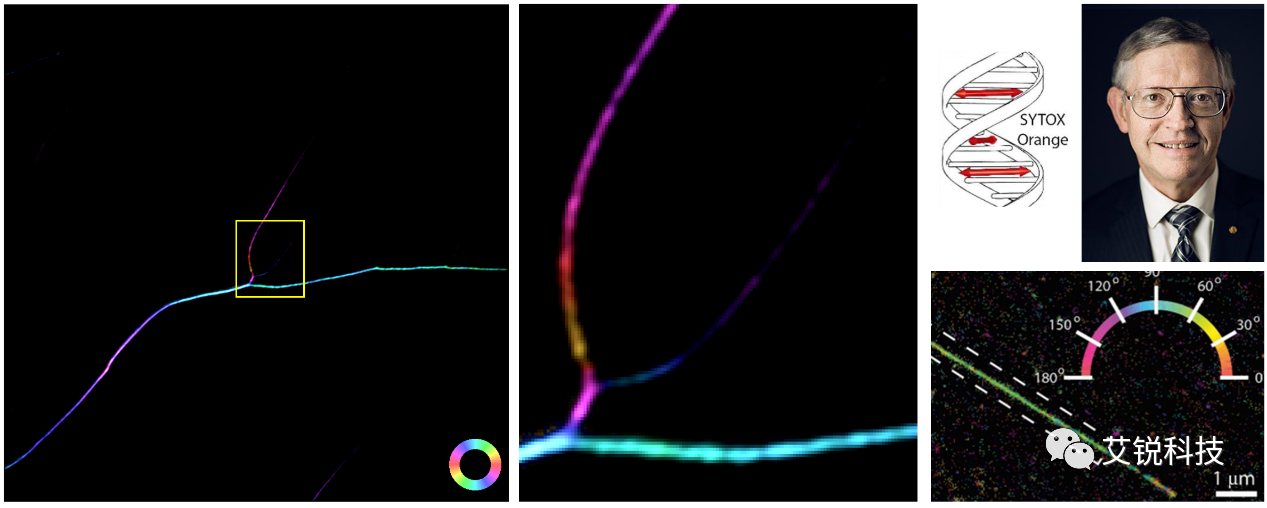
而利用GFP标记细胞微管,则能够看到完全不同的结果。在这一样品中,由于GFP分子垂直嵌入了微管的凹槽中,导致整体的偏振呈现了垂直的偏振结果(图 2)[1]。
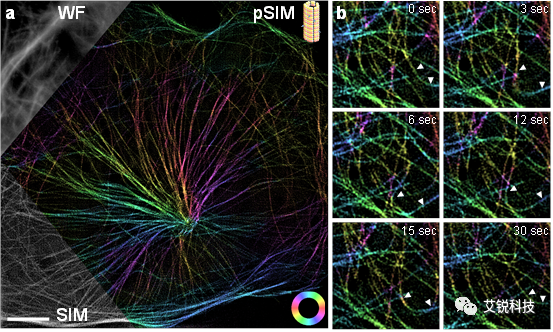
(二)马达蛋白与微丝蛋白的相互作用
马达蛋白是一种重要的细胞蛋白,负责细胞中的物质输运。他们一般会沿着微丝、微管等细胞骨架进行运动,非常类似杂技演员走钢丝的动作。在本研究中,我们将杂技演员“倒立蹬缸”,观察钢丝(微丝蛋白片段)受到马达蛋白(myosin)作用而展开的平移运动(gliding)。我们发现,较长的actin可以很清楚地看到其方向,而随着actin缩短,对于小于衍射极限的小片段,在图像上就是一个点,很难判断其方向。而利用Polar-SIM在空间和偏振两个维度的超分辨,则可以很清晰地观察到actin的延伸方向与偏振角度。可以看出,用Phalloidin染色的actin表现出了平行排列的特点。进一步,我们研究了actin的运动方向与延伸方向,发现对于小的片段,二者高度一致。
有意思的是,当杂技演员(myosin)能量充足时,actin可以体现很好的gliding效果。而当myosin的ATP供应不足时,actin的运动则会体现出wobbling的甩尾方式(一端在动,另一端则固定下来了)。SIM的高时间分辨率使得系统能够捕捉到这一运动过程。
视频:actin-myosin相互作用:(上)能量充足,体现了actin gliding;(下)能量不足,actin的wobbling动作。
(三)在肌动蛋白-血影蛋白排列中的应用
2019年的BreakThrough Prize颁给了华人女科学家、哈佛大学庄小威教授。她在超分辨显微方面做出了多项杰出的工作,其中一个著名的工作便是利用双色STORM对神经细胞MPS结构中的肌动蛋白-血影蛋白(actin-spectrin)排列方式的解析。这一结构在神经细胞轴突起始结、血红蛋白等关键生物细胞中均扮演着重要作用。
在2013年的Science上,庄教授揭示了,actin和spectrin在空间上呈现了一种周期性排列的关系。由于actin被adducin切割为一个个小的片段(约2 nm),而spectrin则是一个长度约为180 nm的蛋白,因此在这一模型中,actin通过end-to-end首尾相接的模型连接,将spectrin扎成一捆,从而形成了周期排列结构[3, 4]。
这一模型是否完整表现了actin和spectrin的组装关系呢?或者说,是否还有其他可能?
为了回答这一问题,北京大学席鹏教授与北京大学麦戈文脑研究所张研教授合作,利用Polar-SIM对这一体系重新进行了成像。实验结果发现,在树突区域,actin的偏振与延伸方向平行;在轴突的MPS区域,由于SIM的空间分辨率可达100nm,因此180nm的actin-spectrin组装能够清晰地展示出来。在这一区域,如果按照end-to-end模型的排列方式,则actin的偏振方向是与MPS延伸方向垂直的;体现到偏振上,这一段的偏振就应该呈现出蓝色。然而,该区域红色的偏振提示我们,actin的排列并不是end-to-end,而应该是转过90度的平行排列。
基于这一事实,我们重新对actin-spectrin的组装关系进行了建模:我们认为,他们的关系应该是side-by-side的插入关系。这一发现修正了以往模型中,由于角度分辨率不足所带来的认识偏差,为结构生物学提供了新的依据。
PolarSIM虽然空间分辨率只有100 nm,远不及单分子定位成像20 nm的空间分辨率,但是在这一问题上,由于单分子只有一个位点,actin排列方向无法通过单分子定位准确获得。而PolarSIM在角度上的高灵敏度为解决这一空间构象问题提供了新的解决思路。
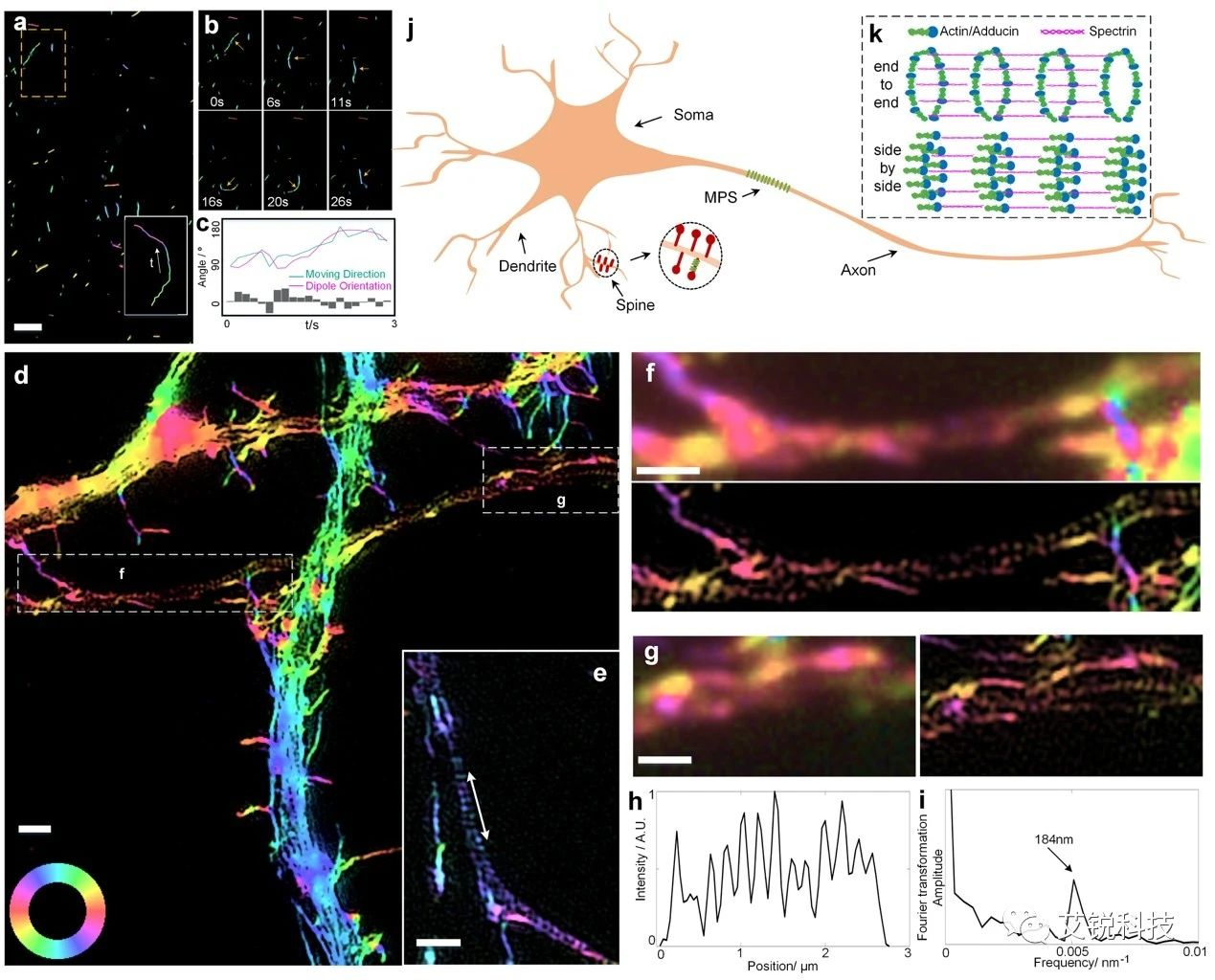
图 4 海马神经元中肌动蛋白丝的 2D-pSIM 成像,可清楚地区分树突中的连续长肌动蛋白丝和轴突中离散肌动蛋白环结构的区域。pSIM显示短肌动蛋白丝的取向与轴突轴平行,支持肌动蛋白环结构的并排组织。比例尺:1 μm。
偏振SIM得到的这一结果是否真实?在我们投稿的过程中,也有审稿人提到了这一问题,并提出希望能够用电镜对两者进一步解析来判断。然而,由于电镜制样的复杂性,因此当时没有更多证据能够证明这一问题。
而就在2023年4月11日,北京大学生命科学学院高宁课题组在Cell期刊在线发表了题为Structural basis of membrane skeleton organization in red blood cells 的研究论文[5]。经过大量的条件优化,课题组成功从猪血红细胞中分离出了膜脂被完全清除、在冷冻电镜条件下具有较好分散度的膜骨架网格,并对内源膜骨架系统进行了冷冻电镜结构分析,最终获得了junctional complex的高分辨结构,揭示了junctional complex和膜骨架组装的分子细节,完整地展示了actin-spectrin-spectrin fiber的空间组装为平行关系,并阐释了其组成因子在膜骨架组装和稳定性维持方面的分子机制。这一研究以极高精度揭示了膜骨架组装中肌动蛋白-血影蛋白(actin-spectrin)的组装关系为平行排列,以及actin和spectrin如何锚定(见动画)。

图 6 电镜下的actin-spectrin的组装关系:与PolarSIM的结果完全一致。
超分辨显微成像因其成功突破了光学显微系统的衍射极限而获得2014年诺贝尔奖。而在过去,对荧光的分析往往局限在对其强度的分析上。挖掘荧光所能够带来的多维度信息,如光谱、偏振、荧光寿命等,能够在新的维度上揭示更为丰富的细胞器信息。在本文中,列举了一些典型的荧光偏振所带来的对细胞器的排列、结构、动态的案例。
“工欲善其事,必先利其器”。偏振SIM作为一种新的成像技术,带来了对细胞器的结构与功能的全新认识,并揭示了染料与目标结构的组装角度,以新的维度向我们展示了蛋白的空间构向信息。它在actin、microtubule等细胞骨架,DNA折叠,和膜性细胞器的膜方向性方面可以发挥重要作用。希望对大家有启发。
3. Xu, K., G. Zhong, and X. Zhuang, Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science, 2013. 339(6118): p. 452-456.
4. Sigal, Y.M., R. Zhou, and X. Zhuang, Visualizing and discovering cellular structures with super-resolution microscopy. Science, 2018. 361(6405): p. 880-887.
5. Li, N., et al., Structural basis of membrane skeleton organization in red blood cells. Cell, 2023.
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。






