前沿:《Nature Photonics》突破,高通量超分辨显微成像照进现实
撰稿|哈尔滨工业大学 博士研究生 韩镇谦(论文一作)
超分辨成像技术的出现标志着成像领域对于光学衍射极限的突破,也极大地推动了生物医学领域的发展。利用超分辨技术,生物学家得以对病态细胞内的亚细胞结构进行精准的量化统计和直观的可视化分析。然而,常见的超分辨技术往往需要复杂的采集设备和特定的成像控制,并且时间分辨率低,成像通量不足,这限制了超分辨成像在生物医学中的广泛应用。基于荧光涨落物理特性的超分辨成像技术(Super-resolution optical fluctuation imaging,SOFI)是一种经典的基于统计学的超分辨方法,可以在不借助额外光学元件的条件下突破衍射极限。但传统的SOFI技术往往需要1000帧以上的原始图像用于重建,自2009年提出,至今仍然难以满足生物医学中对于大视场和细胞器瞬时动态等研究的高通量成像需求。
哈尔滨工业大学李浩宇/赵唯淞团队与北京大学陈良怡团队合作在Nature Photonics上在线发表论文Enhanced detection of fluorescence fluctuations for high-throughput super-resolution imaging。他们提出可以利用预解卷积技术对图像进行处理,以提升荧光涨落现象的开关对比度,从而将重建所需的原始图像数量缩减至少两个数量级。同时在计算自相关累积量后再次进行解卷积,以进一步提升结果的分辨率。基于上述原理,他们发明了自相关两步解卷积超分辨成像(Super-resolution imaging based on Auto-Correlation with TWo-step Deconvolution,SACD)方法,在无需额外硬件的条件下,实现了目前活细胞中通量最高的超分辨成像。从原来的需要1000帧的成像降低到只需要20帧,就能实现2~3倍的三维空间分辨率提升。结合商业的转盘共焦(Spinning Disk Confocal,SDC)显微镜,可以实现快速毫米级视场成像或者四维活体成像。

研究建立了荧光成像的前向传播模型(图1a),在真实的实验中,荧光信号不仅包括焦内荧光分子,还包括焦外和胞质溶胶荧光背景。然后,伴随背景的荧光涨落信号被显微系统的PSF卷积,并由传感器采样。在这一过程中,荧光信号的实际测量值将始终偏离SOFI所需的波动模型,使得原始图像中的信息利用率不高。故研究提出了自相关两步解卷积超分辨成像(SACD)方法(图1b),首先对原始图像执行预解卷积,这一独特的处理增强了荧光信号的开关对比度,抑制了背景噪声,使得计算自相关统计量所需的原始数据帧数显著减少。同时在计算自相关累积量后再次进行解卷积,以进一步提升结果的分辨率。
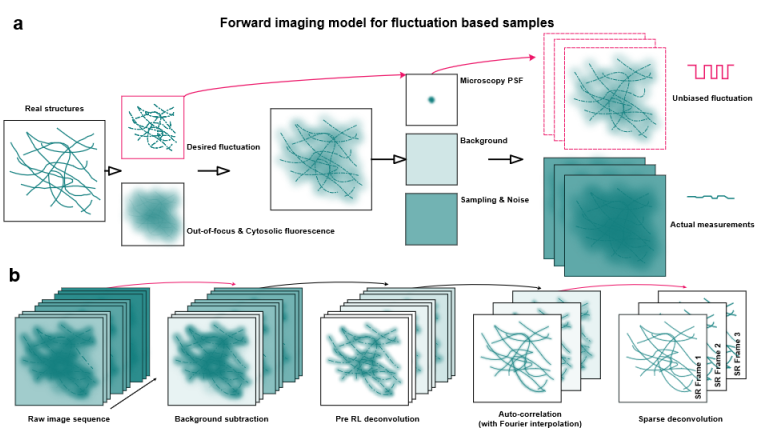
图1 SACD原理及工作流程
(a)荧光成像的前向传播模型。(b)SACD的工作流程。
研究者采用结构光超分辨显微镜(SIM)对使用量子点标记的微管进行成像。使用20帧原始图像重建的SACD结果成功地解析了与相应2D-SIM图像相同的细胞骨架结构。通过对相邻微管细丝的双峰分析,发现SACD的分辨率可达120 纳米,2D-SIM的分辨率可达124纳米。通过傅里叶环相关(Fourier ring correlation,FRC)分析,研究者进一步确认了宽场成像(270纳米)、SOFI (211纳米)、SIM (122纳米)和SACD(102纳米)的分辨率,证明了SACD的分辨率提升能力。
研究团队将SACD方法应用于转盘共焦(Spinning Disk Confocal,SDC)系统,实现了对毫米级(2毫米 × 1.4毫米)视场内微管的高通量超分辨成像,包含多达2000个细胞。传统SOFI需要几乎半天的连续采样才能对整块区域完成重建,而SACD只需10分钟便可达到更加优越的成像性能。在任意区域中,SACD都保持了极高的分辨率,能够清晰地分辨邻近的微管结构,解析出转盘共焦显微系统无法得到的高频信息。研究者们对Nop56和B23这两种核仁蛋白进行了活细胞成像(图2b-e),SACD在保持线性强度的同时还能可靠地提高分辨率,同时具有比SIM更高的对比度。总而言之,SACD对不同类型生物样品具有广泛适用性。

图2 | SACD高通量超分辨成像
(a) SACD(20帧)在包含2000多个细胞的2.0毫米×1.4毫米区域内实现高通量超分辨率成像, COS-7细胞中的细胞骨架微管蛋白成像结果。(b)用Nop56-Skylan-S标记的活COS-7细胞在宽场显微镜(左)、2D-SIM(中)和SACD(右)下的成像结果。(c)宽场显微镜(第1列)、SOFI(第2列,20帧)、2D-SIM(第3列)、SACD(第4列,20帧)的结果比较(b中白框所示的放大区域)。(d)用B23-rsFusionRed3标记的活COS-7细胞在宽场显微镜(左)、2D-SIM(中)和SACD(右)下的成像结果。(d)宽场显微镜(第1列)、SOFI(第2列,20帧)、2D-SIM(第3列)、SACD(第4列,20帧)的结果比较(d中白框所围的放大区域)。比例尺:(a)100微米;(b, d)5微米;(c, e)1 微米。
为了克服低信噪比与长时程的活细胞成像条件,研究团队在SACD的基础上引入了之前开发的稀疏解卷积技术(该团队于去年发表在《自然-生物技术》期刊上,Weisong Zhao et al., Nature Biotechnology, 40, 606–617, 2022)。Sparse-SACD使快速而复杂的细胞器动态过程得以可视化,实现在超过10分钟的时间内对COS-7活细胞线粒体进行快速动态成像。得益于该技术的高通量与稳定性,线粒体被解析为中空的膜状细胞器,整个细胞中线粒体的裂变和融合过程都被清晰地记录下来。
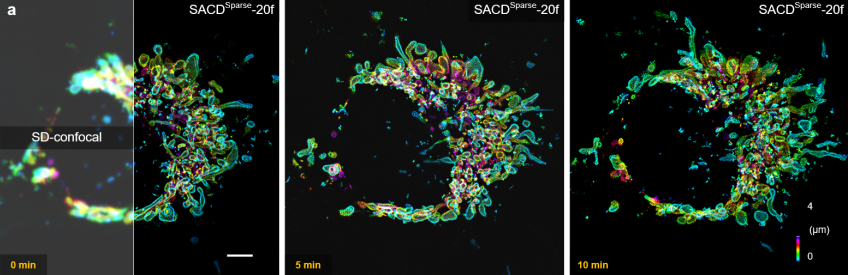 图3 SACD活体四维超分辨成像
图3 SACD活体四维超分辨成像
(a)SDC(左)和Sparse-SACD(右)在37°C下对Skylan-S-TOM20标记的活COS-7细胞进行四维成像。比例尺:5微米。
形象地说,分布在荧光背景中的单个分子波动信号就像“迷雾中闪烁的星星”,SACD在计算统计量之前尽可能地消除了这种“迷雾”,以便在真实的生理环境下实现高质量的超分辨成像。通过充分利用原始图像中的荧光涨落信息,SACD打破了现有超分辨技术的通量限制以及需要特殊光学控制的设备限制,同时其能够直接应用于现有商业化共焦荧光显微镜系统(或其他任何荧光系统)中,有助于低成本、高通量地进行相关生物医学研究,有望成为生物学家分析细胞结构和瞬态动力学的常规工具。
最后,值得一提的是,SOFI技术的发明者,德国乔治-奥古斯都-哥廷根大学教授J. Enderlein是该工作的审稿人之一。J. Enderlein表示:“在涨落分析之前进行预解卷积的想法很新颖,非常合理,因为这应该是消除虚假涨落的好方法”、“使用这种技术呈现的图像质量非常好”、“我认为所提出的方法会是更优的”。
赵唯淞,哈尔滨工业大学,仪器科学与工程学院,助理教授。主要从事光学显微成像技术及其生物医学应用的研究,聚焦于超分辨荧光显微镜、计算成像、深度学习、生物信息学等。以第一/通讯作者身份在《Nature Biotechnology》、《Nature Photonics》等期刊发表论文,担任《Nature Methods》等顶级杂志的特邀审稿人,参加国外重要学术会议主题/邀请报告10余次,授权中国发明专利以及国际PCT专利10余项。实现目前活细胞光学成像方法中分辨率最高(60 nm)、速度最快(564 Hz)、成像时间最长(1小时以上)的模态、以及有效通量最高(0.2 mm2/min)的超分辨显微镜。相关工作入选“2021中国光学领域十大社会影响力事件”、“2022年中国光学十大进展”应用研究类提名奖。承担多项纵向项目。欢迎对于成像技术、机器/深度学习、生物医学应用、前沿交叉研究感兴趣的硕士/博士研究生以及博士后加入,一起探索下一代生物医学成像与分析新技术。
李浩宇,哈尔滨工业大学,仪器科学与工程学院,教授,2022年入选国家优秀青年科学基金。哈尔滨工业大学青年科学家工作室学术带头人。近年来,在国际期刊和会议上发表论文100余篇,研究成果被国内外多家媒体报道。以第一/通信(共)作者在Nature Biotechnology、Nature Photonics、Nature Communications、Photonics Research、Optics Letters、Optics Express等期刊发表学术论文50余篇。入选2021年中国光学领域十大社会影响力事件。入选2022年中国光学十大进展(应用研究类提名奖)。参加国内外学术会议并作邀请报告30余次,申请中国专利20项,国际专利10项。主持国家自然科学基金(青年、优青、仪器专项)和国家重点研发计划课题等。任中国仪器仪表学会青年委员;《激光与光电子学进展》杂志青年编委。
陈良怡,北京大学,未来技术学院,博雅特聘教授、北京大学国家生物医学成像科学中心副主任。1995年西安交通大学生物工程与医学仪器系学士,1998、2001于华中科技大学分别获生物电子学硕士和生物医学工程博士。2001-2004年美国华盛顿大学生理和生物物理系博士后。2004-2010年中国科学院生物物理研究所副研究员。2010年至今在北京大学分子医学研究所担任研究员,2019年获聘北京大学长聘教授,2021年加入北大-清华生命科学联合中心。他还是北京大学麦戈文脑研究所、北京智源人工智能研究院、北京市协同创新研究院的兼职研究员,并担任多模态跨尺度生物医学成像设施装置 II 的负责人、以及多模态跨尺度生物医学成像设施组织所举办的怀柔论坛的主要负责人。获得国家自然科学基金委杰出青年基金和优秀青年基金资助,是科技部重点研发专项、基金委重大研究计划集成项目的首席科学家。
哈尔滨工业大学助理教授赵唯淞为论文第一作者,论文共同第一作者还包括北京大学特聘副研究员赵士群、哈尔滨工业大学博士生韩镇谦和丁相妍。哈尔滨工业大学李浩宇教授和北京大学陈良怡教授为论文的通信作者。其中,另外共同通信作者还有哈尔滨工业大学丁旭旻教授和京津冀国家技术创新中心/北京大学郭长亮副研究员。哈尔滨工业大学谭久彬院士为论文共同作者。
Weisong Zhao#, Shiqun Zhao#, Zhenqian Han#, Xiangyan Ding#, Guangwei Hu, Liying Qu, Yuanyuan Huang, Xinwei Wang, Heng Mao, Yaming Jiu, Ying Hu, Jiubin Tan, Xumin Ding*, Liangyi Chen*, Changliang Guo* & Haoyu Li*, Enhanced detection of fluorescence fluctuations for high-throughput super-resolution imaging, Nature Photonics, 2023.
论文地址:https://doi.org/10.1038/s41566-023-01234-9
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。