Nat. Methods | 生物力学显微成像新方法
撰稿:杨帆博士(欧洲分子生物学实验室,现任中科院上海光学精密机械研究所研究员、博士生导师)
本文由论文作者团队(课题组)投稿
生物体的力学特性(如弹性和粘性)在决定生物功能方面发挥着重要的作用。在细胞尺度上,弹性和粘性特性调节细胞分化和迁移,并决定细胞如何响应周围的环境。细胞力学特性的变化与许多人类疾病息息相关,如转移性癌症、心血管疾病、炎症、传染病中宿主与微生物的相互作用。在组织水平上,组织的力学特性是形态发生和多细胞组织的主要驱动因素,并且对许多疾病(如眼病、癌症或动脉粥样硬化)的发生和进展至关重要。
现有的粘弹性的测量方法要么仅限于样品表面,要么缺乏适当的三维亚细胞分辨率。如原子力显微镜是目前力学生物学领域的黄金标准,它可以提供纳米尺度的高横向空间分辨率,但测量结果是沿接触(轴向)方向的平均值,并不能测量细胞内部的细胞器,而且在很大程度上依赖于力学模型来提取杨氏模量值。
布里渊显微镜(一种光学弹性成像技术)作为一种非破坏、无标记和无接触的方法出现了,它能以三维衍射极限分辨率探测生物样品的粘弹性特性,这引起了生物和医学研究界越来越多的关注。然而,常见的布里渊显微成像技术基于自发布里渊效应,其光谱分辨率取决于光谱仪(如VIPA),目前的限制约为500 MHz,因此其光谱测量的特异性有限,无法分辨两个光谱很近的事件。最近的一个工作利用受激布里渊效应(Nature Methods 17, 913(2020)),将之前的光谱分辨率提升至100 MHz,但其需要的光功率为265 mW,极大地限制了其在生物力学成像中的广泛应用。
近日,欧洲分子生物学实验室(EMBL)Robert Prevedel博士领导的团队与EMBL的多个团队合作提出利用脉冲的泵浦探测方案来解决当前受激布里渊显微技术中的这一“痛点”,将所需照明光功率降低10倍。脉冲照明方案降低了受激布里渊显微镜的光毒性,并可对线虫胚胎、斑马鱼幼体和类器官等敏感样品的力学特性进行成像。

脉冲受激布里渊显微镜原理与优势
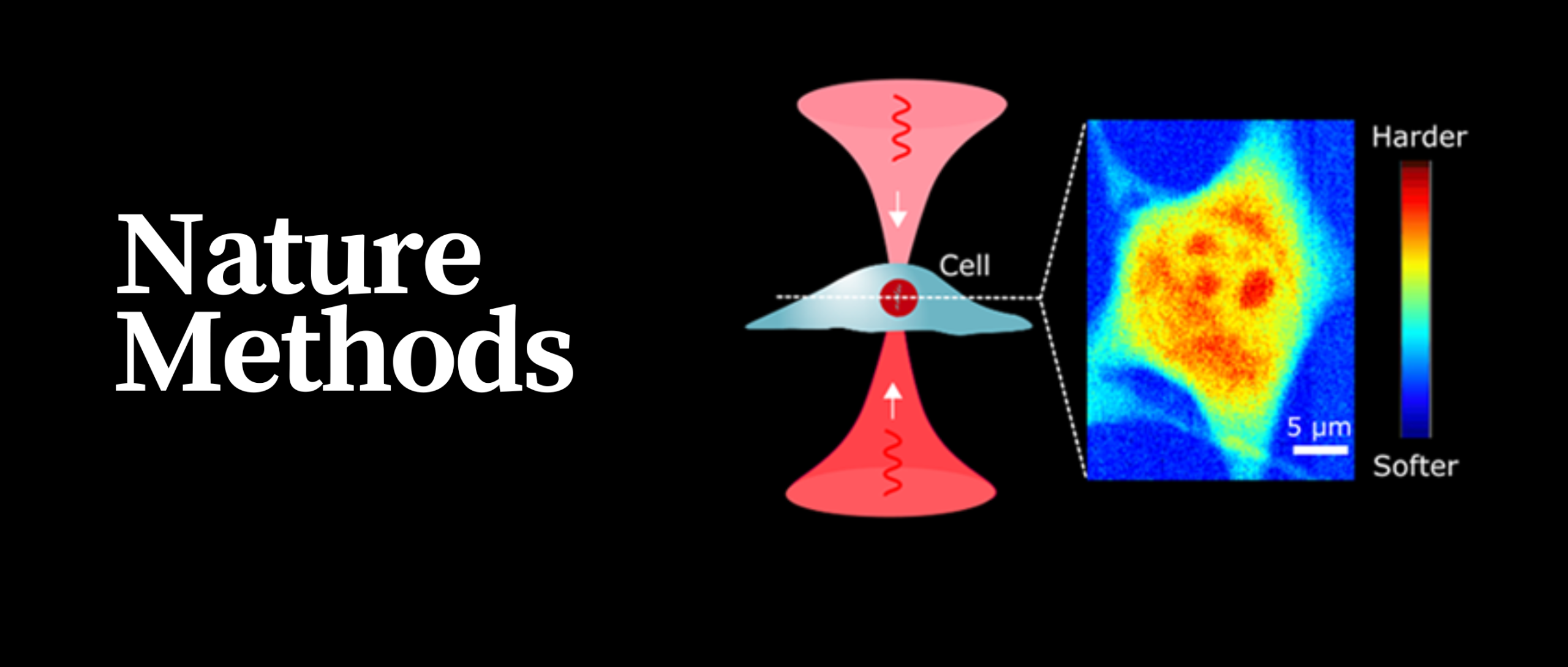
与自发布里渊散射仅需要一束光不同的是,受激布里渊散射(SBS)需要频率略有不同的泵浦光和探测光反向传播并聚焦在样品中的同一个地方(图1a)。由于SBS是一种非线性效应,其信号正比于泵浦光功率、探测光功率以及它们的相互作用时间。因此,具有同样平均功率的脉冲方案和连续光方案相比(图1b),其信号强度增大了E倍(E=1/占空比)。而具有同样平均功率的脉冲方案和传统连续光方案相比,其噪声相同。因此,在相同激光功率下,脉冲方案的信噪比要高出E倍。这种增强可用于降低泵浦功率,同时保持相同的信噪比。

细胞的脉冲SBS成像
实验中首先获取了NIH/3T3小鼠成纤维细胞、原代人脑微血管内皮细胞和小鼠胚胎干细胞的脉冲布里渊图像(图2为小鼠成纤维细胞)。使用脉冲SBS方案获得的布里渊频移图像质量好、信噪比高,从中可以清晰地分辨出具有微小硬度差异的亚细胞区,如细胞核核仁。用细胞死亡标记物碘化丙啶染色并测量其荧光图像表明,脉冲SBS方案成像15小时后,成像细胞中没有细胞膜损伤。而使用传统的连续光方案,在对5个Z平面进行成像后,观察到明显的细胞膜损伤。这表明,脉冲SBS方案适用于活细胞的三维力学显微成像。

图2:培养细胞的脉冲受激布里渊成像。比例尺为5um。
图源:Nature Methods
活体斑马鱼的高特异性脉冲SBS成像

图3:斑马鱼幼虫的受激脉冲布里渊成像。比例尺为5um。
图源:Nature Methods
脉冲SBS可实现对线虫胚胎的实时成像
为了最终证明脉冲SBS方法的低光毒性及其在整个形态发生过程中可视化动态组织特性的能力,该团队捕获了发育中的秀丽隐杆线虫胚胎从受精后约300-480分钟,即从 “bean”期到”1.5 fold”期的二维布里渊延时图像(图4)。该团队观察到不同胚胎身体部位和胚胎阶段的硬度存在差异。胚胎后部的硬度较高,而胚胎后部主要由内皮细胞组成,这些细胞将形成肠道(图4)。在脉冲SBS成像后,线虫胚胎仍保持活性和活力,所有成像的胚胎都会正常发育,最终孵化成有生命力的幼虫。而使用传统连续光方案,在获取几张二维图像后就能观察到胚胎损伤和死亡。这表明脉冲SBS与使用~265 mW的传统连续光方案相比有了显著的改进。
总结
利用受激布里渊散射效应的非线性特点,使用脉冲的泵浦和探测方案将传统SBS的泵浦功率从300mW降低了10倍并保持了好的成像质量和光谱分辨率,证明了传统SBS方案对于很多光敏生物样品都无法实现活体测量,而该团队观察到了活体的胚胎发育、类器官成长中的粘弹性的变化,首次实现了细胞、胚胎、生物体和类器官的低功率、高光谱分辨率和高信噪比的三维力学成像,为布里渊显微这个三维、非侵入式、高空间分辨率力学成像方法在细胞生物学、胚胎发育学、生物力学以及可能的癌症和药学分析的应用打下了重要的基础。
部分作者简介
论文信息
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。