客厅里做出诺奖工作,白茨格的传奇人生
Eric Betzig | 撰文
杨晓雨 | 翻译
任知微 | 校译
李栋 | 审稿

2014年诺贝尔化学奖得主Eric Betzig。图源:诺奖官网
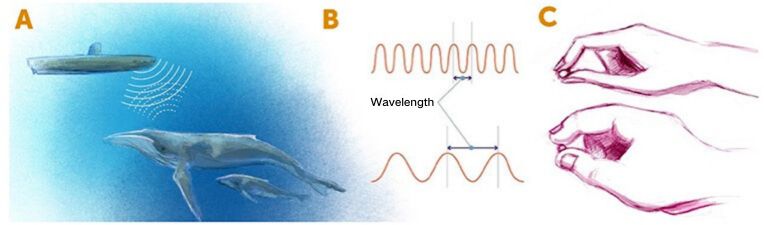 图1:利用辐射探测物体。(A)在潜艇的声纳系统中,声波辐射用以探测附近物体。潜艇发射声波,接收到声波辐射的附近物体将其反弹回声纳系统的探测器。同理,人眼(探测器)看见物体实际上是接收到了由物体反射回的光波。(B)辐射类型可以由波长描述,即两个辐射波相邻波峰之间的距离。(C)短波(上)类似利用纤细手指感知物体的细节,而长波(下)类似胖乎乎的手指只能“看见”明显的特征。
图1:利用辐射探测物体。(A)在潜艇的声纳系统中,声波辐射用以探测附近物体。潜艇发射声波,接收到声波辐射的附近物体将其反弹回声纳系统的探测器。同理,人眼(探测器)看见物体实际上是接收到了由物体反射回的光波。(B)辐射类型可以由波长描述,即两个辐射波相邻波峰之间的距离。(C)短波(上)类似利用纤细手指感知物体的细节,而长波(下)类似胖乎乎的手指只能“看见”明显的特征。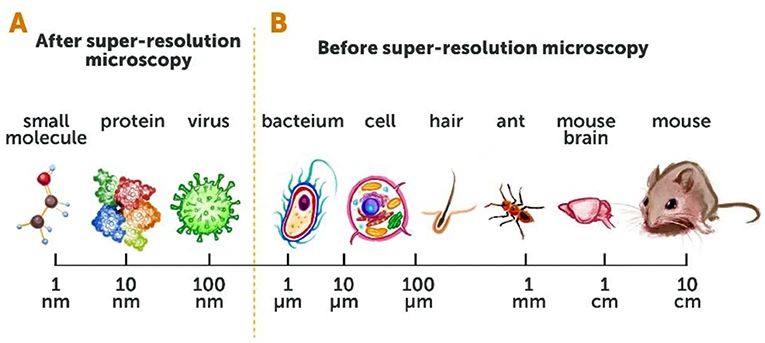 图2:传统显微成像技术vs.超分辨显微成像技术。(A)超分辨显微成像技术拓展了我们所能看清物体的尺寸范围,小至10nm(1nm=0.000000001m)左右。(B)在超分辨显微成像技术问世前,我们只能看见200nm(大约为一个细菌的尺寸)及其以上大小的物体。
图2:传统显微成像技术vs.超分辨显微成像技术。(A)超分辨显微成像技术拓展了我们所能看清物体的尺寸范围,小至10nm(1nm=0.000000001m)左右。(B)在超分辨显微成像技术问世前,我们只能看见200nm(大约为一个细菌的尺寸)及其以上大小的物体。
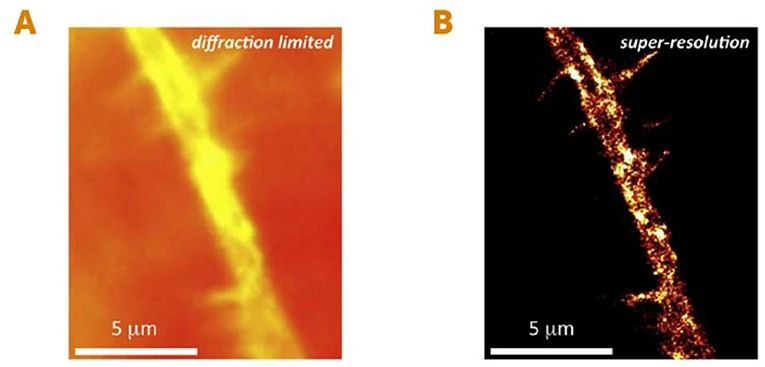
图3:利用超分辨显微成像技术对活细胞内的单个蛋白质进行观测。(A)传统显微成像技术下一个活的神经细胞的分支(B)超分辨显微成像技术下的同一个神经细胞位置。这种方法帮助我们看清了以前所看不到的细节,在这种情况下,我们看到了神经细胞中负责导电的细胞膜上微小的离子通道蛋白(黄色的亮点)[1]。
序幕:近场显微技术
超分辨荧光显微成像技术
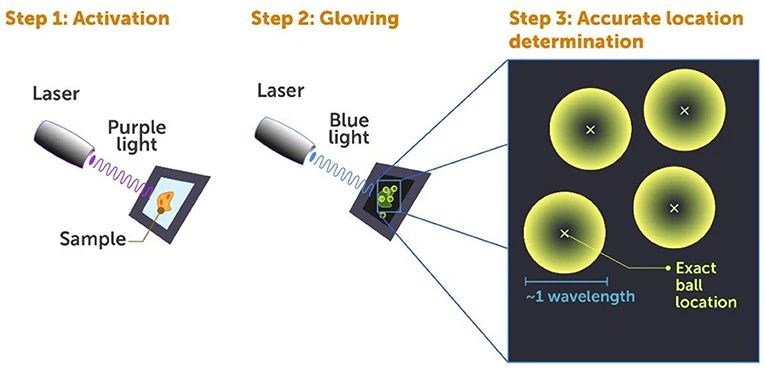 图4:光激活定位显微成像技术(Photoactivated Localization Microscopy, PALM)。PALM中,对荧光标记的细胞进行超分辨荧光成像主要包含三个步骤。第一步:使用能量低的紫外短脉冲光对细胞进行照射,对一部分蛋白上的荧光标记物进行激活准备下一步发光;第二步:蓝色激光照射细胞使其发光并被探测到;第三步:在计算机上通过找到每个发光圆球的中心以确定单个蛋白质的位置。
图4:光激活定位显微成像技术(Photoactivated Localization Microscopy, PALM)。PALM中,对荧光标记的细胞进行超分辨荧光成像主要包含三个步骤。第一步:使用能量低的紫外短脉冲光对细胞进行照射,对一部分蛋白上的荧光标记物进行激活准备下一步发光;第二步:蓝色激光照射细胞使其发光并被探测到;第三步:在计算机上通过找到每个发光圆球的中心以确定单个蛋白质的位置。
如果同时激活所有的标记物,它们将会一起发光造成视觉上的混淆,这也是上述我们看到大发光团的原因。因此我们使用能量非常低的紫外脉冲光对标记物进行激活,如此,每个脉冲一次只能随机激活一小部分标记物,并且这些细胞内部被激活的标记物就可以轻松分辨开来。当我们用蓝光对这些激活的标记物进行探测时,它们就像一个个发光的小球(图4,步骤二),大小大约为光的一倍波长,这是我们用传统显微镜观测时所能看到的最小尺寸(图4,步骤三)。
接下来是此技术的核心步骤。我们使用计算机对采集的图像进行处理,精确找到每个发光小球的中心。你可以想象一个有一定直径的球形篮球,和估计其直径相比,即使你并不能直接看到其中心,也能更为准确地指出球心。同样地,对于这些分子小球也是如此,我们可以以极高的精度找到它们的中心,这比直接确定发光小球的尺寸更接近分子的实际尺寸。这意味着每次我们用光脉冲照射细胞时,都能找到细胞内一小组蛋白质的位置(图4,步骤3)。这些蛋白质的荧光会自然关掉,之后再照射另一组蛋白质并确定其位置。通常,完成对一整个细胞的成像需要激活数万次,但这样的付出是值得的,因为我们获得了一张分辨率极高的细胞图像或是其他研究中的物体图像。(图3B及Betzig等人论文中的图片[9])。
超分辨显微成像技术的挑战和机遇
如你所知,PALM十分简单,所需的只是一台产生照明光束的激光器、一台相机和一个用于找到发光蛋白质中心的简易程序。这一套设备既便宜又简单。实际上,我和我的朋友Harald Hess教授是在他的客厅里搭建出了第一套PALM模型,当时我们都处于失业状态,设备都是自掏腰包。
困难的部分在于对生物样本的处理。我们遭遇了许多棘手的问题,包括生物样品的制备、避免光对细胞的损伤,以及找到一种最佳方法来探测分析我们感兴趣的分子发出的光。
在准备细胞时,实验表明,许多可以激活的标记物并没有附着在我们实际想看的蛋白质上,而是分布在附近的其他物体上。这意味着我们使用的标记物实际上并没有指向我们感兴趣的蛋白质的位置。此外,即使我们设法标记到正确的蛋白质,也只有一小部分被标记,常常不足以以最高的分辨率获得细胞的完整图像。尽管增强光照强度可以获取的信息更多,但如果我们尽力正确标记足够多的蛋白质,细胞可能无法承受如此强烈的光。因此,我们总是在试图获取尽可能多的细胞信息的同时,尽量减少对细胞的损伤。
我要提到的最后一个困扰是光漂白现象。光漂白描述了一个标记物只能发光有限次数的现象。换言之,对于一个特定标记物,在其被彻底破坏前只能发出一定量的光。在某些情况下,这些光不足以让我们提取到足够的信息找到标记物的精确位置。
正如我之前所提及的,超分辨荧光显微技术是一项无与伦比的技术,它让我们得以窥见活细胞和活体组织的奥秘。在这种技术的帮助下,我们不仅能确定活体生物样本的结构,还能在一定时间内跟踪细胞内部的动态过程,如蛋白质的运动。凭借所谓单分子追踪的方法,我们可以深入研究活体细胞的最深处,见证生命的最基本过程[10,11]。例如,这种方法曾经帮助我们探悉RNA复制物是如何由细胞核内的DNA产生的,这一过程被称为转录。
追踪单个分子并能够探明它们在细胞内的运动,对于新药物的开发至关重要。在我看来,我们以前无法看到但现在可以捕捉到的与细胞机制有关的信息,可能会引领我们迈向一个全新的药物研发阶段,开创针对多种疾病的重要新型治疗方式,如阿尔兹海默症和帕金森症等。我相信,这也许是超分辨显微成像技术带来的最宝贵的贡献,也是我和同事们将我们创办的制药公司命名为Eikon Therapeutics的原因。
对年轻人的建议
 图5:对年轻人的一些建议。当你规划你的未来蓝图时,尝试去做一些你热爱并且对社会有用的事情。
图5:对年轻人的一些建议。当你规划你的未来蓝图时,尝试去做一些你热爱并且对社会有用的事情。就我个人而言,我发现我做这种研究时有很多优势。首先,我是自己的老板,我享受这种可以自己决策而不是被安排去做事情的感觉;其次,在我的科研领域中,我力图为认真回答我专业范围外科学问题的人们发明新的工具,这意味着我必须学习许多新东西,成为“全能专家”。我对许多领域的知识都略知一二,从不同的设备中哪种材料表现最好,到生物学和物理学,再到设计新的研究工具,这些广博的知识渗透入我的日常生活中,使得我博物洽闻,畅享这个美妙而复杂的世界。
最后,我想探讨的是应该以什么态度面对自己做出的选择。首先,永远以批判性思维面对所遇到的麻烦,不要满足于表面的机械化思考,要推究根源,寻其本质;第二,不要惧怕冒险,在我看来,这个世界已变得过于安逸,限制了个人和社会创新以及进步的能力;最后,努力工作至关重要!无论你在做什么,处于何种年龄阶段,尝试在快乐中进步,即使前路崎岖,也不要妄自菲薄,要全力以赴去实现目标。如果你对某事并不擅长也没有关系,因为每个人都有不同的专长,没有人是无所不能的。但在做任何事情时都要不遗余力,有志者事竟成。找到你真正热爱的事情,全心全意投入其中,学有所长,尽你所能并乐在其中。
[2]Ash, E. A., and Nicholls, G. 1972. Super-resolution aperture scanning microscope. Nature 237:510–2. doi: 10.1038/237510a0 [3]Betzig, E., Harootunian, A., Lewis, A., and Isaacson, M. 1986. Near-field diffraction by a slit: implications for superresolution microscopy. Appl. Opt. 25:1890–900. doi: 10.1364/AO.25.001890 [4]Betzig, E., and Chichester, R. J. 1993. Single molecules observed by near-field scanning optical microscopy. Science 262:1422–5. doi: 10.1126/science.262.5138.1422 [5]Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., and Prasher, D. C. 1994. Green fluorescent protein as a marker for gene expression. Science 263:802–5. doi: 10.1126/science.8303295 [6]Betzig, E. 1995. Proposed method for molecular optical imaging. Opt. Lett. 20:237–9. doi: 10.1364/OL.20.000237 [7]Patterson, G., and Lippincott-Schwartz, J. 2002. A photoactivatable GFP for selective photolabeling of proteins and cells. Science 297:1873–1877. doi: 10.1126/science.1074952 [8]Shroff, H., White, H., and Betzig, E. 2013. Photoactivated localization microscopy (PALM) of adhesion complexes. Curr. Protocol. Cell Biol. 58:4–21. doi: 10.1002/0471143030.cb0421s58 [9]Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., et al. 2006. Imaging intracellular fluorescent proteins at nanometer resolution. Science 313:1642–5. doi: 10.1126/science.1127344 [10]Liu, Z., Lavis, L. D., and Betzig, E. 2015. Imaging live-cell dynamics and structure at the single-molecule level. Mol. Cell. 58:644–59. doi: 10.1016/j.molcel.2015.02.033 [11]Li, D., Shao, L., Chen, B. C., Zhang, X., Zhang, M., Moses, B., et al. 2015. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science 349:aab3500. doi: 10.1126/science.aab3500
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。







