说明 | 本文来自论文作者(课题组)投稿
黑夜中有一个物品,而这个物品本身又不会发光,那怎么才能找到它呢?
最好的方法之一,就是在它旁边,放一个会发光的小物体,用这个小物体的光,来“标记”我们要找的物品的位置。
细胞中的荧光成像就是这样一种观察生物大分子的特异方法:在黑夜中,在犹如茫茫人海的生物大分子海洋里,人们在某种特定的生物分子旁标记出荧光,从而可以间接得知这种生物分子的空间位置。人们可以利用荧光标记的各种属性(包含荧光强度、光谱、荧光寿命和偏振),这些属性在生物研究中都可以发挥重要作用。
其中,偏振光就可以实现对荧光偏振特性的研究。偏振光和荧光团的相互作用可以通过电偶极子来表示:电偶极子是由分离的正负电荷形成的,偶极矩表示偶极子的强度及其方向。当激发光的电场方向平行于偶极矩的方向时,荧光团吸收光子的机会最大,激发出的荧光光强也越强。
所以,生物标记的偏振性质可以用偶极子取向来表示,很容易通过偏振激发和偏振探测等方式得到。这种取向测量被广泛地应用在与分子排列和旋转相关的生物机制研究中。
然而,传统显微镜的分辨率极限(名词解释 >)大约为 200 纳米,这一分辨率大大限制了偶极子取向研究在机制研究中的应用。
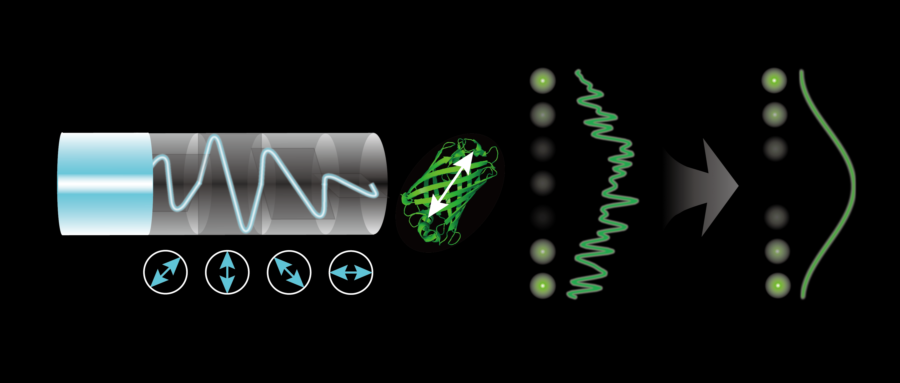
受激发射损耗(STED)显微镜、光激活定位显微镜(PALM)、随机光学重建显微镜(STORM)和结构光超分辨显微镜(SIM)等技术,在时间和光谱等维度上将光学显微镜的分辨率提高到纳米等级。在偏振这个维度上,科学家们使用偏振激发调制(如图 1 所示。偏振激发调制,是指对激发光进行偏振调制,激发荧光样本),针对强各向异性的结构和高信噪比质量的图像,实现超分辨重建和取向测量。然而,在活细胞样本的成像、亚细胞器相互作用以及物质运输的研究中,存在的弱各向异性和弱信噪比等情况,会大大减弱真正要探测的信号,此时,偏振调制的信号往往会被淹没。
图 1:旋转偏振激发光(蓝色光线,下测箭头方向为线偏振光偏振方向)激发荧光偶极子(图中所示为 GFP 分子),产生经过余弦平方调制的带有噪声的光强曲线,经锁相探测后(灰色箭头)生成平滑的无噪声的余弦平方曲线。曲线左侧的光斑为同一周期内在不同时间点的光强光斑
锁相探测(名词解释 >)是一种典型的对比度增强的成像方法。常见的光学锁相探测大多依赖于荧光探针的非线性相应,通过提取与调制信号一致的频率成分(如图 2 所示),达到去噪和提取相位的目的。这种方法一般需要特殊设计的探针和可控制的脉冲激光源,也需要通过硬件同步或者图像分析的方法,获取具备调制频率的参考信号。
图 2:锁相探测原理:将探测信号与参考信号进行锁相,可以提取无噪声的信号和信号相位
在以往的研究中,研究者们为了实现超分辨重建,在传统宽场荧光系统中添加了偏振激发调制。根据偏振激发信号和采集到的信号,清华大学北京国家信息科学与技术研究中心的高军涛副研究员和北京大学未来技术学院的席鹏研究员合作开发了一种基于锁相探测技术的超分辨荧光偶极子映射方法(OLID-SDOM)。
该成果以"Polarization Modulation with Optical Lock-in Detection Reveals Universal Fluorescence Anisotropy of Subcellular Structures in Live Cells"为题发表在 Light: Science & Applications。
本文中,研究者利用荧光激发调制和光学锁相探测,提取被调制的荧光信号,去除噪声,并进行超分辨重建和取向提取。具体如下:
研究者利用旋转半波片和偏振补偿器,生成偏振方向持续旋转的激发光,根据马吕斯定律可知:该激发光照射到荧光偶极子上时,会产生光强符合余弦平方规律的荧光。
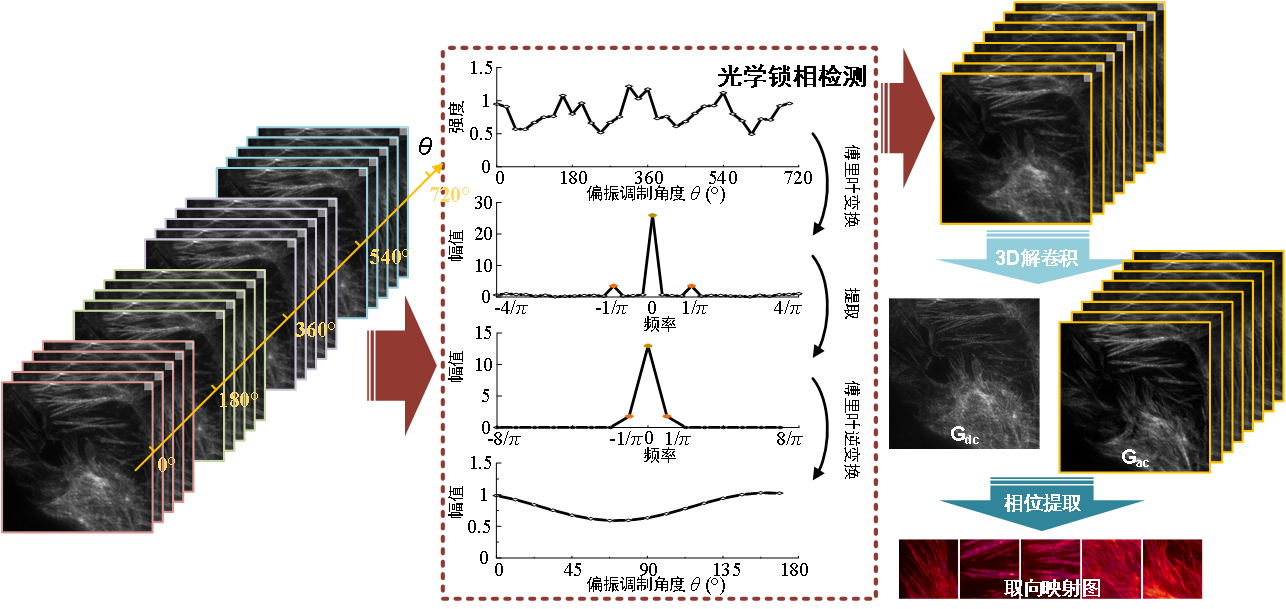
如图 3 正中红色虚线框内的流程所示,研究者将余弦平方的频率作为调制频率,在探测到的信号中提取该频率,分离得到和偏振相关的 AC 信号以及和偏振无关的 DC 信号,丢弃其他频率信号,进行去噪。去除噪声后,即可提升原始图像的信噪比。此过程,就是研究者在本文中用到的锁相探测方法。
图 3:OLID-SDOM 流程图:将多周期的图像数据沿调制方向进行锁相探测,随后进行三维解卷积和相位提取,可以得到超分辨偶极子取向的结果
随后,利用三维解卷积对锁相探测后的处理图像进行超分辨重建。三维解卷积的方法具体如下:将锁相探测后的处理图像分为 DC 分量(和偏振无关)和 AC 分量(和偏振相关),分别与点扩展函数进行解卷积,即分别在(x, y)和(x, y, θ)域上进行解卷积,并将两种分量结合起来迭代产生最终的重建结果(包括 DC 分量和 AC 分量)。该过程使用的算法为 FISTA 算法,此算法可以加快求解速度。根据解卷积求得的 DC 和 AC 分量,逐像素提取相位,也就是在像素水平上求解偶极子取向。为了定量评估单像素下偶极子的有序程度,研究者们定义了趋向一致性因子(OUF)这个概念,其值分布在 0~1 之间。当 OUF 趋向于 1 时,说明取向越有序、一致;趋向于 0 时,则说明单个像素中的分子的排布越混乱。
根据目前系统上硬件的性能,新技术 OLID-SDOM 的时间分辨率最高可达 100 帧每秒,理论上空间上最高可以分辨 50 纳米的距离(基于仿真结果),且可以快速提高偶极子的二维取向,使其适合于监测与方向变化相关的结构动力学。
随后,研究者们利用 OLID-SDOM 技术研究了多种 GFP 标记的亚细胞器,包括线粒体、溶酶体、高尔基体、核内体等的各向异性,发现亚细胞器的各向异性与细胞器的功能有关,这种各向异性可以用上文提及的 OUF 来量化。OUF 很可能可以作为区分正常和异常细胞(比如癌细胞)的一个潜在指标。
此外,OLID-SDOM 的一个显著优点,是可以用于活细胞成像。例如,溶酶体和肌动蛋白的双色超分辨成像显示了 OLID-SDOM 在动态分子相互作用研究中有较大的应用潜力(如图 4)。实时 OLID-SDOM 则可以用于观察活神经元中树突棘扩张和收缩的细微各向异性变化。
图 4:U2OS 细胞溶酶体和肌动蛋白的双色 OLID-SDOM 成像
综上所述,通过光学锁相放大,OLID-SDOM 揭示了以前无法观察到的荧光各向异性,并显示了活细胞中这些荧光分子的潜在的动态分子结构变化。这一新技术为活细胞超高时空多维度成像研究又添新利器。
Guan et al. Light: Science & Applications (2022) 11:4
https://doi.org/10.1038/s41377-021-00689-1