封面 | “无衍射光束”走入“显微成像”世界

文章链接:王璐艳, 郭宗林, 王思元, 侯春风, 王健. 无衍射光束在生物显微成像中的应用[J]. 激光与光电子学进展, 2023, 60(20): 2000001.
无衍射光束是指在传播过程中波包或横截面强度分布保持稳定的一类光束,具有无衍射、自修复、自加速的传播特性。这些特性为远场成像在多个方面的性能提升提供了天然条件。无衍射特性可抑制光束在传播过程中的衍射,有助于提高成像的分辨率。自修复特性可使光束在透过强散射介质后快速恢复波前,提高成像景深和信噪比。自加速特性可增加光场信息的有效探测维度,实现多维重构成像。
理论上,无衍射光束可看作是不同角谱平面波的线性相干叠加,各平面波的相对相位差保持不变,可抑制衍射,使波前分布稳定传播。当遇到不透明物遮挡,即使部分平面波分量通过,也可以通过干涉重建遮挡的部分而恢复原有的波前分布,因此无衍射光束具有自修复和自加速特性。实验上,为了获得有限能量光束,可以在角谱上叠加一个有限孔径的光阑进行截趾,实现在特定传播区域内的无衍射光束传播。
1.贝塞尔光束
贝塞尔光束的横截面光场分布是贝塞尔函数的形式,传播过程中具有高度局域性。根据相干理论,贝塞尔光束可看作由角谱为传播矢量位于锥面上的平面波的相干叠加,各平面波振幅保持不变,相位被方向角φ调制,即A(φ)=A0exp(inφ)。当相干叠加的各平面波相位差不变,得到0阶贝塞尔光束,其光强分布为:![]() 。由于光强分布与光束传播距离z无关,表现出无衍射特性。
。由于光强分布与光束传播距离z无关,表现出无衍射特性。
实验室最早用于产生贝塞尔光束的方法是环缝法。根据贝塞尔光束的数学形式,在频域内采用圆环缝,并进行傅里叶变换,即可产生贝塞尔光束。随着空间光调制技术的发展,为了方便调控光束的传播特性,实验上通常使用环形相位板在频域内调控高斯光或平面波的频谱,再通过傅里叶变换产生贝塞尔光束。
艾里函数Ai(x)是波动方程的特殊解,艾里光束光强可表述为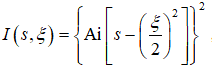 ,其中
,其中![]() ,x0为所谓的尺度缩放因子,由艾里光束自身决定。艾里光束能量沿着抛物线s=(ξ/2)2传播,具有横向自加速特性,在x-z坐标下横向偏移距离为
,x0为所谓的尺度缩放因子,由艾里光束自身决定。艾里光束能量沿着抛物线s=(ξ/2)2传播,具有横向自加速特性,在x-z坐标下横向偏移距离为![]() 。由于积分
。由于积分![]() 的值趋于无穷大,意味着艾里光束蕴含的能量无穷大,现实中无法实现。为了在实验中产生艾里光束,需要引入指数衰减因子进行截趾,利用频域调控技术制备出有限能量的艾里光束。
的值趋于无穷大,意味着艾里光束蕴含的能量无穷大,现实中无法实现。为了在实验中产生艾里光束,需要引入指数衰减因子进行截趾,利用频域调控技术制备出有限能量的艾里光束。
在实验上产生艾里光束多采用空间光调制器调制平面波光场的方法。平面波经立方相位调制,而后进行傅里叶变换,在透镜后焦面即可产生艾里光束。
光片显微镜采用薄层光片照明样品,探测方向与照明方向垂直,有效缓解了传统显微成像在深度方向上离焦背景光的交扰,具有较高的成像信噪比。在共聚焦模式下,在深度方向平移光片,可实现三维体成像。由高斯光束产生的光片,由于衍射原因,光片在离焦后快速展宽,因此光场激发的均匀性和成像视场受到限制。而贝塞尔光片可以突破这一限制,为生物组织内深层结构观测提供一种新的技术途径。图1(a)是Fahrbach[1]等人设计的贝塞尔光片显微镜,在几个瑞利距离内光片的厚度均匀,拓展了成像视场。实验结果表明,贝塞尔光片在透过玻璃球后能够快速恢复波前结构,从而抑制光散射,提高照明深度(图1b)。
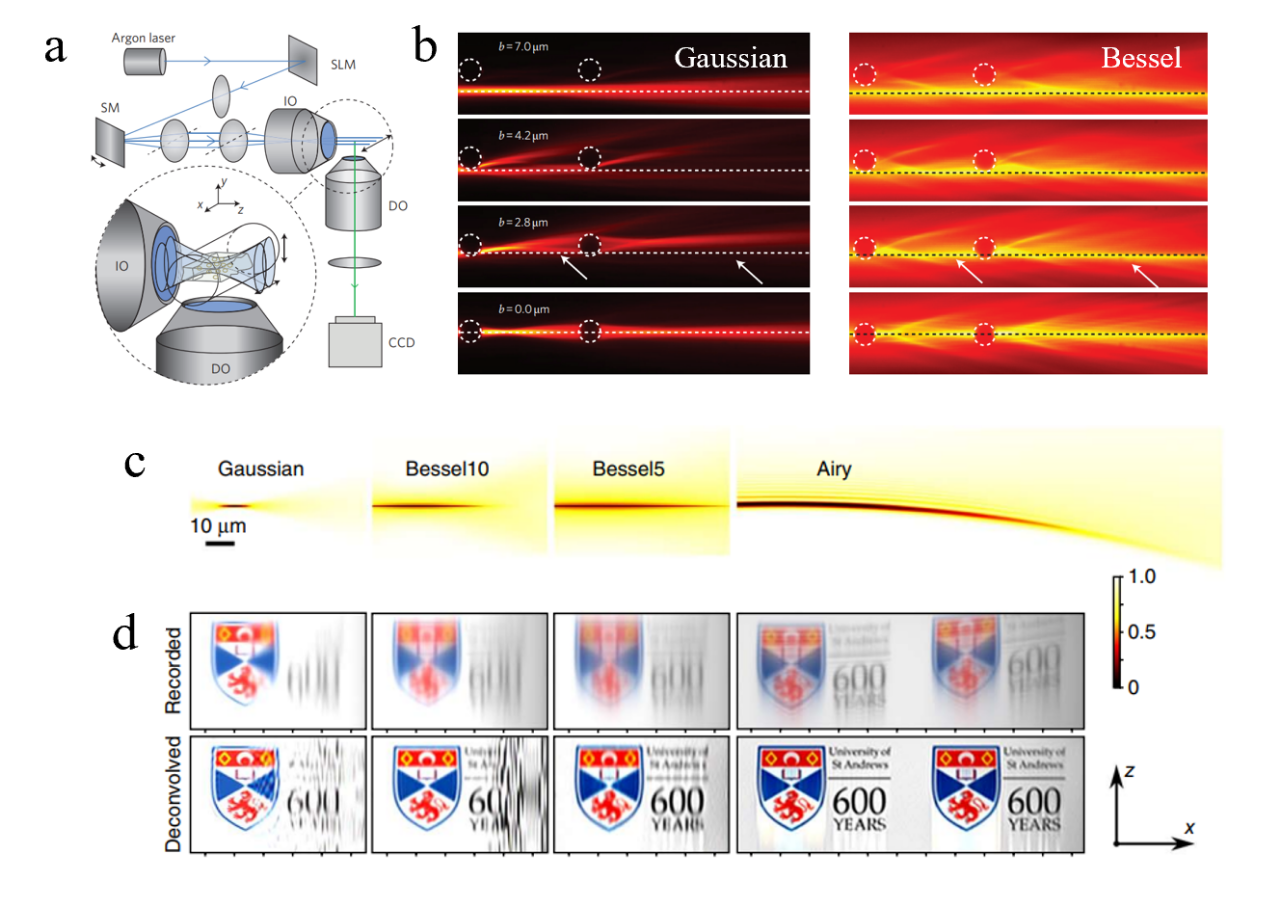
图1 无衍射光束在光片显微镜中的应用研究。(a)贝塞尔光片显微镜结构示意图;(b)高斯光束和贝塞尔光束透过玻璃球的传播截面强度分布;(c)高斯光束、贝塞尔光束和艾里光束x-z平面强度分布;(d)三种光束的成像仿真
Vettenburg[2]等在光片显微镜中采用艾里光片照明,并与高斯光片、贝塞尔光片照明进行了比较。研究表明,艾里光片具有更长的传播距离,通过调控光场特性能够大幅增加成像视场(图1c)。在相同的数值孔径下,艾里光片的视场分别是高斯光片和贝塞尔光片成像视场的10倍和4倍。由于艾里光束的点扩散函数(PSF)是非对称结构,去卷积处理更为有效(图1d),因此成像分辨率更高。
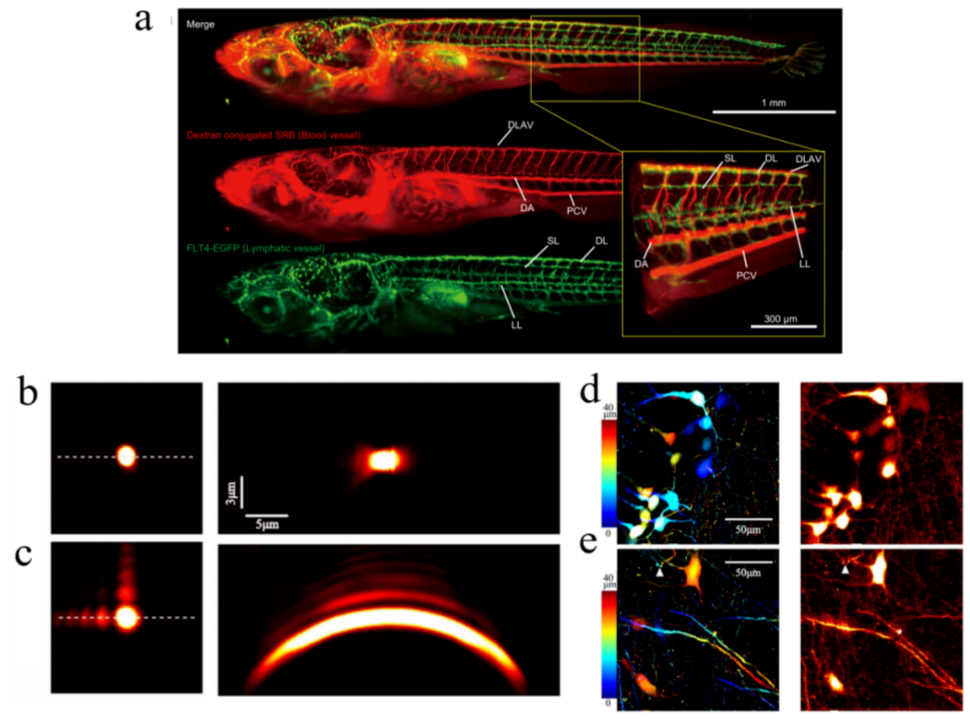
双/多光子显微镜基于共聚焦成像原理,样品在光束会聚点同时吸收两个/三个光子实现荧光激发,会聚点外不激发,从而降低成像背景噪声,减小光毒性。贝塞尔光束的无衍射特性能够提高组织内的光传播距离,实现大景深并行扫描成像。此外,其自修复特性也有利于光束精准会聚,并保持光强稳定、提高成像速度。Takanezawa[3]等使用双光子贝塞尔光束激发,实现了毫米深度的青鳉鱼幼体双色快速三维成像(图2a),成像速度为~3/4 mm3/s,轴向分辨率为2~3 µm。艾里光束的无衍射特性也提升了多光子显微镜的成像性能。Tan[4]等研究了艾里光束照明对多光子显微成像的影响。相对于传统的高斯光束激发,艾里光束PSF主瓣的横向尺寸仍保持较高的分辨率,但其纵向半峰全宽(21. 30 µm)是高斯半峰全宽(3.05 µm)的6倍以上,因此成像视场在轴向大幅提升(图2(b)-(c)。图2d和2e是小鼠脑切片分别在高斯光z扫描(对深度进行色彩编码)和艾里光束单帧2D扫描的成像图。
受激拉曼显微镜通过探测样品的拉曼散射信号区分样品的化学成分进行三维成像,适用于非标记活体细胞。传统的受激拉曼显微镜利用聚焦的高斯光束对样品进行二维扫描,而对于三维体积成像,需要轴向移动样品或高斯光束焦点。因此,样品体积越大,成像越耗时,且要求高斯光束长距离保持紧聚焦,成像深度受限。贝塞尔光束的无衍射和自修复特性确保了光束在生物样品内长距离传播的方向性和均匀性,有益于提高成像深度。
受激发射损耗显微镜(STED)通过荧光饱和吸收损耗的方法压缩高斯光激发的PSF,能够突破传统的分辨率极限,且成像过程无需后续处理。由于采用单点测量和平面扫描相结合的成像方式,导致成像速度慢,且易带来光损伤。基于贝塞尔光束的STED(图3a)通过调控光场相位产生0阶激发光和1阶激发损耗光(图3b, c),并通过两种光束对样品的共轴激发,构建贝塞尔-高斯STED显微镜[5]。成像过程中,光源可同时激发光束线上的所有荧光分子,相对于传统的单点激发,有效提高了成像速度。此外,该激发模式也避免了单点激发的能量累积,缓解了光漂白和光损伤。
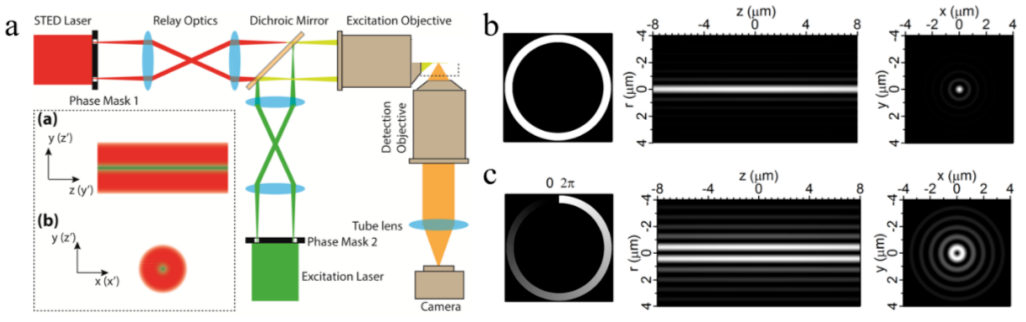
图3 无衍射光束在受激发射损耗显微镜中的应用。(a) 贝塞尔光束STED显微镜光路示意;(b)0阶贝塞尔光束的调制相位、r-z和x-y平面的强度分布;(c) 1阶贝塞尔光束的调制相位、r-z和x-y平面的强度分布
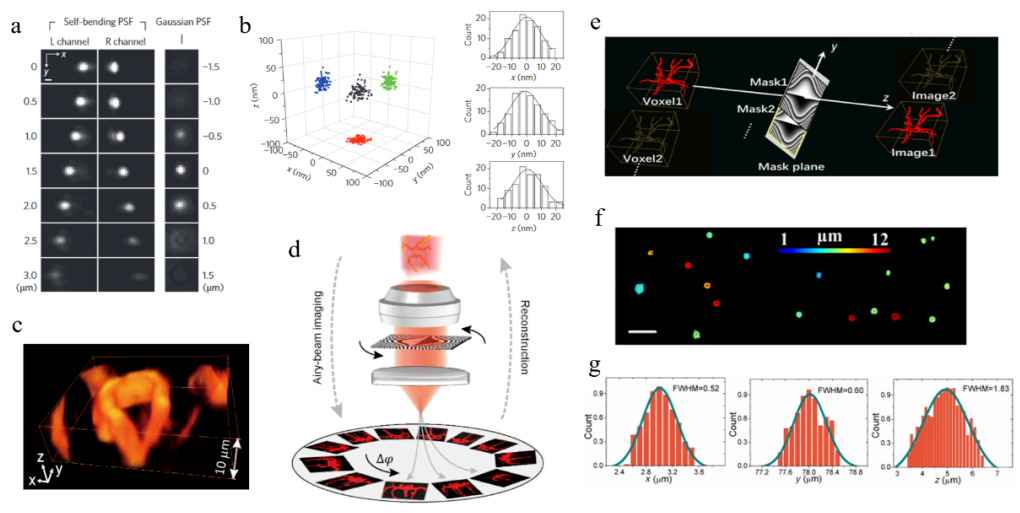
艾里光束独特的横向自加速特性将光束的轴向传播深度与横向偏移距离相关联,因此测量光束的横向偏移量即可解析并定位荧光粒子的空间位置。Jia等[6]首次将艾里光束应用于STORM成像系统,通过调控荧光发射端的高斯光场产生对称偏移的双艾里光束PSF(图4a),通过均化处理确定荧光粒子的深度信息,结合STORM系统的二维定位,实现了基于STORM的三维超分辨成像(图4b),在3 µm的成像景深下定位精度达到10-15 nm。
2020年,哈工大王健研究组根据艾里光束的自弯曲传播特性,提出了基于Tomography原理在探测端实现的艾里光束三维重建显微镜ATM(图4d)[7]。通过点扩散函数工程调控艾里光束传播特性,制备了无旁瓣艾里 PSF,在散射型介质内的无衍射传播距离达到15-20 µm。通过旋转调控相位板产生等效于不同方向的艾里投影图像,并使用自研算法对投影图像进行重构,实现了横向分辨率400-500 nm、深度方向分辨率~1.5 µm的小鼠肾细胞三维无扫描成像(图4c)。2022年,该研究组进一步分析了非傍轴下艾里光束调控理论[8]。提出了相位平移并重组的方法拓展成像视场(图4e)。实验中,通过两次平移调制相位,实现了150 µm × 50 µm × 12 µm的三维成像(图4f)。
无衍射光束的传播本质是子波阵面的相互干涉和不断递推的过程,即使遇到阻碍也能够通过子波干涉重建固有波前,因此适合在环境复杂的介质内传播。近年来,随着光束调控技术的发展,并与生物显微成像应用相结合,推动了成像性能的提升,但仍有许多科学和技术问题尚待研究。例如:实验产生的无衍射光束如何保持更长距离的传播以提高成像景深?近年来多种干涉和滤波技术应用于无衍射光束的点扩散函数工程,是否存在最优化的方法及其如何实现?无衍射光束旁瓣对显微成像分辨率和信噪比带来影响,它既涉及光束产生和调控的理论和技术问题,也涉及图像处理和重建算法。
无衍射光束技术应用于生物显微成像领域,既是机遇也充满挑战。本文仅对部分研究成果进行了整理,难免偏差或遗漏,希望起到抛砖引玉的作用。
参考文献:
[2] Vettenburg T, Dalgarno H I C, Nyla J, et al. Light-sheet microscopy using an Airy beam[J]. Nature Methods, 2014, 11(5): 541-544. [3] Takanezawa S, Saitou T, Imamura T. Wide -field light-sheet microscopy with lens-axicon -controlled TWo-photon Bessel beam illumination[J]. Nature Communications, 2021, 12(1): 1-15. [4] Tan X J, Kong C H, Ren Y X, et al. Volumetric two-photon microscope with a non-diffracting Airy beam[J].Optics Letters, 2019, 44(2): 391-394. [5] Chen X L, Zhang C, Lin P, et al. Volumetric chemical imaging by stimulated Raman projection microscopy and tomography[J]. Nature Communications, 2017, 8(1): 1-12. [6] Jia S, Vaughan J C, Zhuang X W. Isotropic 3D super-resolution imaging with a self-bending point spread function[J]. Nature Photonics, 2014, 8: 302-306. [7] Wang J, Hua X W, Guo C L, et al. Airy-beam tomographic microscopy[J]. Optica, 2020, 7(7): 790-793.
王健,哈尔滨工业大学物理学院,教授、博士生导师,主要从事光场调控与成像、全息技术研究。基于艾里光束实现了高超分辨细胞三维成像;基于自研玻璃态聚合物实现了小型化大容量体全息存储器。承担国家自然科学基金以及多项部委项目,以第一/通讯作者发表Optica、Optics Letters等十余篇,授权国家发明专利6项。
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。







