浙江大学刘旭、匡翠方、郝翔研究团队受邀在《激光与光电子学进展》发表了题为“三维超分辨显微成像技术的研究进展及展望”的综述文章。文中作者从受激辐射损耗显微术和单分子定位显微术这两种主流超分辨显微技术出发,对其衍生出的多种三维超分辨显微成像技术进行了原理介绍和特点分析,最后对其未来发展方向进行了展望。
本封面以漫画的形式展示了受激辐射损耗显微镜和单分子定位显微镜的三维超分辨显微成像原理。激光(孙悟空)经过光学系统(物镜)的变换后,以稀疏的形式激发不同深度下的细胞结构产生荧光(小猴子),实现了凭借微观视角去看微观世界的三维超分辨显微成像。
超分辨显微成像技术是细胞生物学的强大工具,并且其突破光学衍射极限的分辨能力从纳米尺度上为细胞生物学提供新的分析手段,对生命科学相关领域具有重大意义。然而,然而由于阿贝衍射极限[1]的存在,传统光学显微镜(light microscopy)的分辨率受到了限制。在可见光波段,传统光学显微镜的横向分辨率仅为200~300 nm,轴向分辨率为横向分辨率的2~3倍,只能达到500~800 nm。显然,这两个尺寸都远大于许多亚细胞结构,并且超分辨显微镜的轴向分辨率相比于横向分辨率要更难以提高,这导致实现细胞结构亚百纳米分辨率的三维成像更为困难[2-4]。
理论上,结构光照明显微术(SIM)的分辨率极限为传统光学显微镜的两倍,而受激辐射损耗(STED)显微术和单分子定位显微术(SMLM)的分辨率没有限制。因此,本文从STED和SMLM这两种主流技术出发,对目前存在的多种三维成像技术进行了原理介绍和特点分析,最后对其未来发展方向进行了展望。
根据STED的成像原理,要想提升显微成像系统的三维空间分辨率,关键是要让损耗光在样品焦平面处聚焦成一个三维中空暗斑,只有暗斑中心所在位置可以发出荧光,其他位置不发荧光。要想实现这一点,目前的技术主要有基于单物镜架构的3D-STED和基于双物镜架构的isoSTED。
基于单物镜架构的3D-STED的技术关键是对损耗光加载0/π环形相位(也叫作“Top-hat”相位),这种相位分布可以让损耗光经过物镜聚焦成具有焦面中心强度最小、焦面上下强度最大分布的三维暗斑。在这种架构(z-STED)下,基于单物镜架构的3D-STED技术相比于共聚焦显微成像技术,可以获得轴向6倍和横向2倍的分辨率提升,即获得90~110 nm 的近乎各向同性的三维分辨率。为了进一步增大横向的损耗、提升横向分辨率,可以通过再引入一路损耗光加载传统的0~2π涡旋相位,产生一个横向分布的“甜甜圈”形状的环形暗斑,最终将两个暗斑在焦面进行非相干强度叠加,得到横向43 nm和轴向125 nm的分辨率[5],其基本原理如图1所示。除了可以使用相位板对损耗光进行波前调制,也可以利用空间光调制器(SLM)对其进行波前调制[6],此时SLM与物镜后焦面光学共轭。利用SLM,可以方便地实现对损耗光进行像差补偿、和激发光的自动对准等目的。
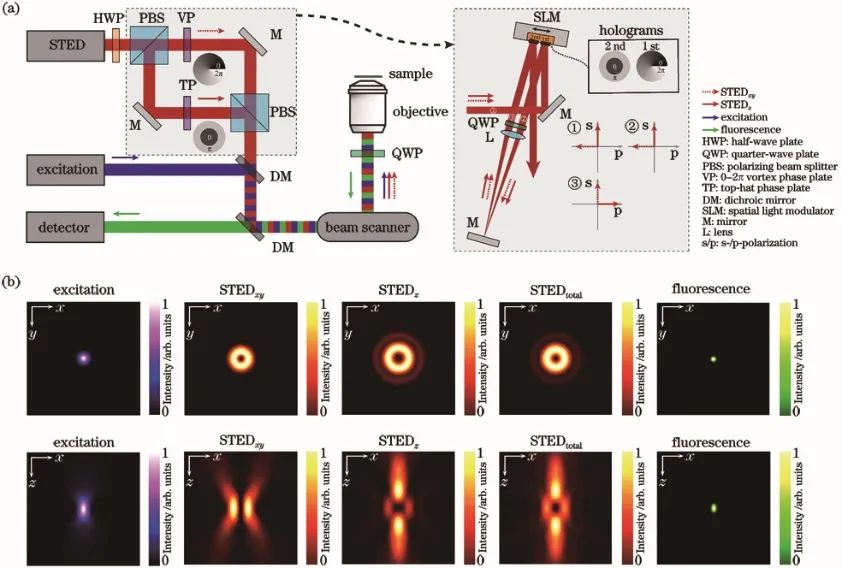
图1 基于单物镜架构的3D-STED纳米显微技术原理图。(a) 光学装置简化示意图;(b) PSF结果
基于双物镜架构的isoSTED 的技术关键是损耗光通过两个对置物镜在样品面发生干涉而形成暗斑。采用两个对置物镜的4Pi显微镜,对荧光样品进行双向激发和双向探测,等效于在轴向上增大了物镜的孔径(得到近乎4π的空间立体角),这样可以减小PSF的轴向大小,极大地提升轴向分辨率。
2002年,研究人员首次将STED与4Pi技术相结合,获得了33 nm 的轴向分辨率[7]。进一步地,2008年研究人员提出的isoSTED 技术可以在此架构下提升横向分辨率,得到40~45 nm 的各向同性分辨率[8],光学原理图如图2所示,STEDxy 和STEDz两束损耗光分别产生横向和轴向分布的暗斑,负责横向和轴向上的分辨率提升。
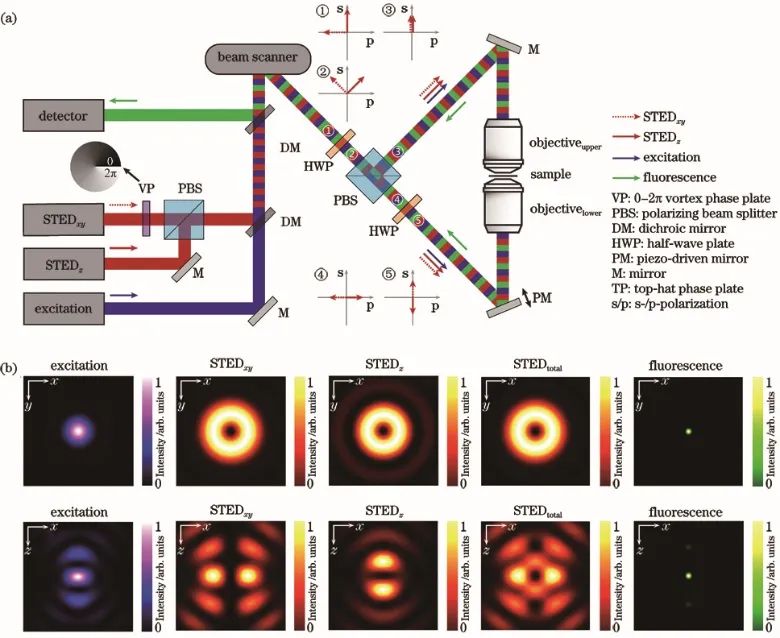
图2 基于双物镜架构的isoSTED纳米显微技术原理图。(a)光学装置简化示意图;(b)PSF结果
在三维成像应用中,成像深度往往受限于成像过程中的光散射和像差,此外,光散射和像差也会影响STED成像中激发光和损耗光的对准以及三维暗斑的质量,影响成像分辨率。为了减小成像过程中的光散射和像差,增大三维成像深度,主要可以从选择合适物镜、采用样品清洁技术和使用自适应光学技术这三个方面进行考虑。
在进行厚样品的深度成像时,物镜浸没液和组织样品的折射率不匹配会导致球差的产生,且球差随着成像深度的增加而增加[9]。虽然高折射率的浸没液会让物镜拥有更大的数值孔径,集光能力更强,理论上会带来更高的成像分辨率,但是其和样品折射率不匹配而导致的球差会降低成像质量。因此,针对不同的组织样品,选择合适的物镜浸没液至关重要。
也可以在样品端入手,样品清洁技术就是通过匹配样品和物镜浸没液的折射率来减小光散射和像差的一种方法,可以提高成像质量、增大成像深度。
此外,使用自适应光学技术可以进一步校正由样品折射率变化导致的像差。自适应光学技术通过动态校正元件(如空间光调制器和变形镜),采用特定的像差测量技术和控制方法(如直接波前测量和间接像差优化)来补偿畸变的波前,提高成像质量[11]。
在单分子定位显微成像中,荧光分子的横向位置可以从其图像中类高斯分布的质心进行确定。但是,其轴向定位的分辨率低和成像深度浅,于是人们提出了多种三维成像技术来进行提高,一般有PSF工程、多位置观测、超临界角荧光和4Pi显微镜等其它方法。
改变PSF的空间分布,将PSF的轴向位置信息编码到PSF的横向形状上,通过横向形状进行轴向定位。这类方法统称为PSF工程。
2008年Bo Huang和Xiaowei Zhuang等人[10]实现了3D STORM。如图3所示,在传统的荧光成像光路中,他们在物镜(objective)和筒镜(imaging lens)之间加入了一个焦距为1 m的柱透镜(cylindrical lens),使得图像在x和y方向受到不同程度的调制。于是,荧光分子的PSF椭圆度和方向随着轴向位置变化。
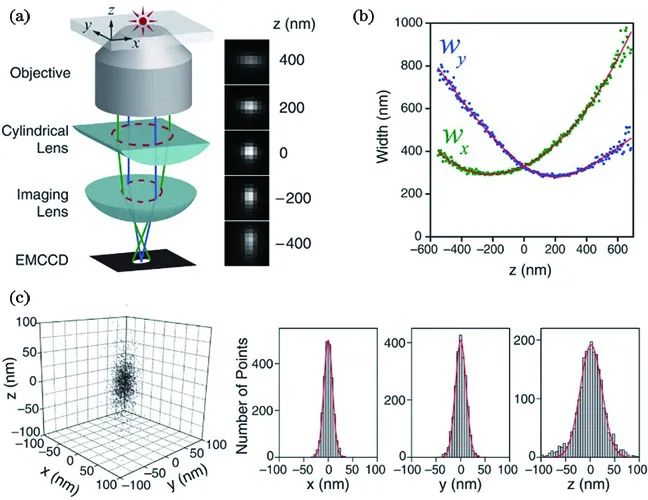
图3 3D STORM示意图[12]。(a)实验装置;(b)校正曲线中图像宽度wx和wy与轴向位置z的关系;(c)单分子的三维定位的分布
类似的方法还包括:自干涉三维超分辨显微镜、双螺旋PSF、艾里光束PSF等。
多位置观测法通过在物方或者像方的不同位置进行同时成像,从中提取物体的轴向位置。
2007年和2009年,Prashant Prabhat和Sripad Ram等人分别提出了多焦面显微镜(MUM)和双物镜多焦面显微镜(dMUM),用于提升三维成像的轴向分辨能力。对于MUM,当两个探测器分别位于焦平面(0 nm)和远离焦平面(500 nm)的位置时,对于同一个分子发出的荧光信号,探测器接收到的信号强度分布是不同的,换而言之就是横向PSF的形状不同。因此,可以通过实验测得深度和PSF形状(信号强度分布)之间的关系,确定荧光分子的轴向位置,或者可以通过PSF模型的理论计算进行定位。
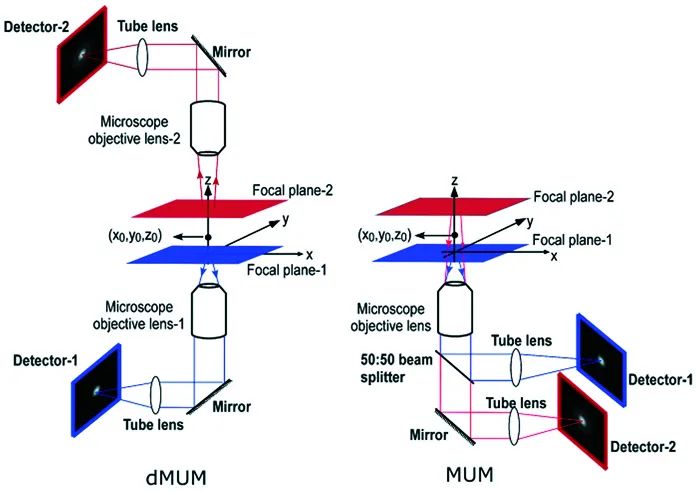
类似的方法还包括:多焦点显微镜、虚体积超分辨成像显微镜、单分子光场显微镜等。
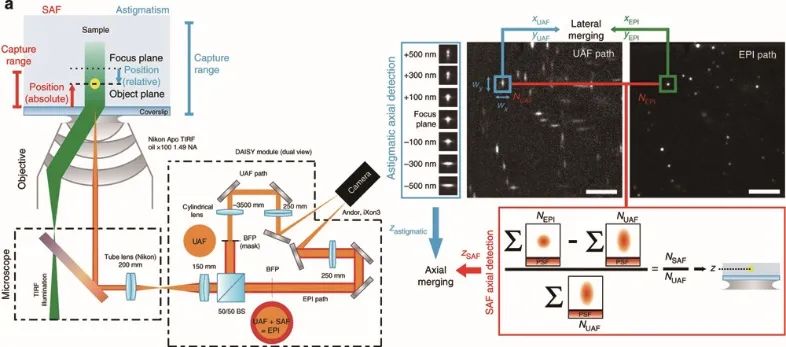
样品和玻璃界面之间存在折射率不匹配的情况。在距离分界面的一定范围内,荧光分子辐射的一部分荧光会以低于临界角的范围射入玻璃,称为低临界角荧光(UAF);另一部分荧光则会以超过临界角的范围入射,称为超临界角荧光(SAF),SAF光子数随着与分界面距离的增加呈指数形式下降。
2015年,N. Bourg等人[12]将dSTORM与SAFM结合,提出一种可直接轴向定位探测的光学纳米显微系统(DONALD)。在DONALD中,他们使用高数值孔径(0.49 NA)的物镜来收集包含SAF在内的落射荧光(epifluorescence),在成像光路的DONALD模块中,落射荧光被分束镜分为两部分,一部分为SAF和UAF,另一部分为UAF(SAF被光阑阻挡)。因为在高NA物镜的后焦面(共轭面)上,SAF和远场UAF在径向上是分开的,所以可以将UAF和SAF分开。这样在EMCCD平面上,可以通过落射荧光与UAF相减得到SAF,再计算与UAF的比值,即可实现轴向定位。理论上DONALD,可以实现5~10 nm的轴向定位精度。
类似的方法还包括:基于SAF的双视场像散成像技术和超临界角定位显微镜等。
在上世纪90年代Stefan W Hell课题组提出了4Pi显微镜(4Pi microscopy)。因为一个物镜在理论上最多可以覆盖空间立体角的一半(2π),所以两个相对的物镜可以实现全空间立体角(4π),故命名为4Pi显微镜。在SMLM中使用4Pi可将干涉条纹中的相位信息转化为轴向位置信息,进而提高轴向分辨率。
2016年Fang Huang和Joerg Bewersdorf等人提出了一种全细胞4Pi单分子开关纳米显微镜( W-4PiSMSN)。首先,他们改进了4Pi-SMS的系统设计;其次,他们对4Pi-PSF偏心距分析算法进行改良,将4Pi-PSF的干涉相位所提供的信息共同用于轴向定位。因此,通过使用W-4PiSMSN对噬菌体、核孔和纤毛等细胞结构的大体积三维成像,其三维分辨率均可达到10-20 nm,并且成像深度最深可达10 μm左右。
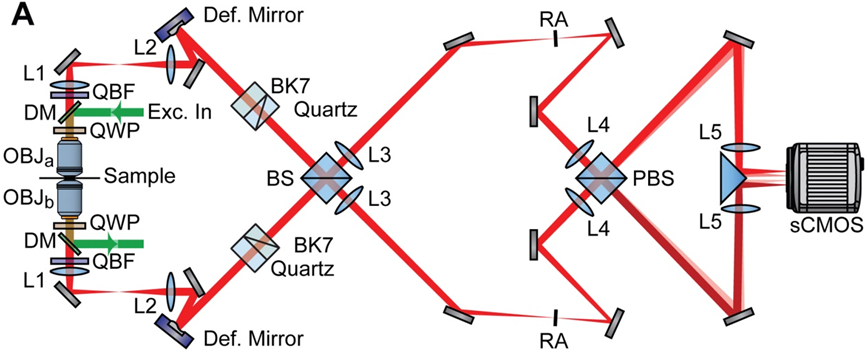
类似的方法还包括:干涉测量型PALM和4Pi单分子开关显微镜等。
此外,在2021年中国科学院生物物理研究所徐涛院士课题组与纪伟课题组提出了一种新型轴向单分子定位成像技术,并命名为轴向定位重复光学选择曝光技术(ROSE-Z)[13]。在单物镜和3000个光子的情况下,轴向定位精度可达2 nm以下,是传统像散方法定位精度6倍以上。在对细胞微管以及线粒体等细胞结构进行三维成像时均实现了纳米精度的分辨率,且轴向深度为500~600 nm,这也证实了ROSE-Z是一种易于使用且功能强大的三维成像手段。
目前,在STED三维成像技术中,三维分辨率的提升既可以通过单物镜架构的3D-STED 技术实现,又可以通过双物镜架构的isoSTED 技术实现,前者相对于后者,架构更为简单且容易实现,但三维分辨率略低于后者。
三维成像深度的增大既可以通过匹配物镜与浸没液折射率来实现,如选择合适的物镜和使用样品清洁技术,又可以通过像差校正的光学技术来实现,如AO STED技术。
在SMLM三维成像技术中,主流技术大致可分为四种:PSF工程、多位置观测、超临界角荧光和4Pi显微镜。本文介绍的每种技术都有各自的优缺点,当我们想要选择某一种系统时,除了成像深度越深和分辨能力越好等优点是我们首要考虑因素外,时间以及金钱成本多和系统复杂程度高等缺点也不能忽视。
对于STED 三维成像技术,实现三维的快速长时程成像,将STED技术和其他技术(如定位显微技术、膨胀显微技术和电子显微技术和深度学习技术)相结合,引入冷冻技术实现超分辨光镜-电镜关联成像将是未来发展的趋势。
总之,经过时代的发展,未来一定会出现更多的新型三维超分辨显微成像技术使科学家能够直接分辨出纳米尺度的生物样品,我们对生命科学将会有更深层次的理解。
[1] ABBE E. Beiträge zur Theorie des Mikroskops und der mikroskopischen Wahrnehmung[J]. Archiv für Mikroskopische Anatomie, 1873, 9(1):413-468.
[2] BO H, SARA A J, BOERRIES B, et al. Whole-cell 3D STORM reveals interactions beTWeen cellular structures with nanometer-scale resolution[J]. Nature Methods, 2008, 5:1047-1052.
[3] 郝翔, 杨青, 匡翠方, et al. 光学移频超分辨成像技术进展[J]. 光学学报, 2021, 41(01):0111001.
[4] 陈宇宸, 李传康, 郝翔, et al. 点扫描移频超分辨显微成像进展[J]. 激光与光电子学进展, 2020, 57(18):180001.
[5] HARKE B, ULLAL C K, KELLER J, et al. Three-dimensional nanoscopy of colloidal crystals[J]. Nano Letters, 2008, 8(5):1309-1313.
[6] GOULD T J, BURKE D, BEWERSDORF J, et al. Adaptive optics enables 3D STED microscopy in aberrating specimens[J]. Optics Express, 2012, 20(19):20998-21009.
[7] DYBA M, HELL S W. Focal spots of size lambda/23 open up far-field florescence microscopy at 33 nm axial resolution[J]. Physical Review Letters, 2002, 88(16).
[8] SCHMIDT R, WURM C A, JAKOBS S, et al. Spherical nanosized focal spot unravels the interior of cells[J]. Nat Methods, 2008, 5(6):539-44.
[9] HELL S, REINER G, CREMER C, et al. Aberrations in confocal fluorescence microscopy induced by mismatches in refractive index[J]. Journal of Microscopy, 1993, 169(3):391-405.
[10] BO H, WENQIN W, MARK B, et al. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy[J]. Science, 2008, 319.
[11] HAO X, ALLGEYER E S, LEE D-R, et al. Three-dimensional adaptive optical nanoscopy for thick specimen imaging at sub-50-nm resolution[J]. Nature
[12] BOURG N, MAYET C, DUPUIS G, et al. Direct optical nanoscopy with axially localized detection[J]. Nature Photonics, 2015, 9(9):587-593.
[13] GU L, LI Y, ZHANG S, et al. Molecular-scale axial localization by repetitive optical selective exposure[J]. Nature Methods, 2021.

课题组隶属于浙江大学光电科学与工程学院光电工程研究所,同时也是浙江大学-舜宇智慧光学联合研究中心的一部分。课题组致力于突破现有显微成像方法的技术瓶颈,开发下一代具有高时空分辨率和大视场的新型超分辨显微成像方法,为生命科学、医学和材料学领域的前沿研究提供新的观察和定量分析手段,为提高全人类福祉贡献自己的力量。实验室目前的研究方向主要包括:超分辨显微成像技术、计算高光谱成像技术、基于光学的人工智能等。
郝翔,浙江大学光电科学与工程学院研究员、博导。曾任霍华德休斯医学研究院(HHMI)、牛津大学神经回路与行为学研究中心(CNCB)访问学者,耶鲁大学医学院助理研究员(Associate Research Scientist)。2018 年10 月全职回国。主要从事高精密光学仪器特别是光学显微镜的研究工作。在Nature Methods、Light: Science & Applications、Physical Review Letters 等期刊上共发表论文80 余篇,获授权专利30 余项,包括美国专利1 项。2017 年,其成果获评当年度“中国光学十大进展(应用研究类)”。学术兼职有《Frontiers of Information Technology & Electronic Engineering》通讯专家、《激光与光电子学进展》专题编辑、中国光学学会生物医学光子学专委会委员。