专家点评:
该综述文章系统、全面、详实地介绍了SMLM技术的工作原理、光路搭建、图像重建、多色成像等关键技术问题,总结了SMLM技术近年来的成像参数指标的发展。文章另一亮点是对SMLM 数据中形态较为多见的簇状结构的聚类分析进行了详尽总结与讨论,还分类介绍了SMLM在细胞生命科学领域中的重要应用进展。
爱因斯坦曾说过:“教育的价值不在于记住很多事实,而是训练大脑会思考”。本综述可为SMLM研究人员和使用人员提供有益的参考,帮助他们思考如何合理应用超分辨率成像工具来解决具体的科学问题。值得注意的是,Nature Reviews系列新期刊《Nature Reviews Methods Primer》在近日发表了题为“Single-molecule localization microscopy”的综述文章,与本文内容形成有效的互补。
陈良怡
北京大学
物理学与生命科学的交叉融合不断推动生命科学研究向精准、可控、可视等方向发展,大大提高了人们观察和解析复杂生命现象的能力。本世纪初诞生了超分辨光学成像技术,突破衍射极限限制,将成像分辨率从传统的200纳米提高至几纳米,迅速发展成为生命科学研究中重要的新兴技术手段。2014年美、德三位科学家因发展超分辨光学成像技术被授予诺贝尔化学奖。2019年著名华人科学家庄小威,因开发超分辨光学显微成像技术并揭示了细胞内隐藏的精密结构而获得科学“突破奖”。
目前主流超分辨成像技术主要可分为两类:一是基于照明光场改造的“受激发射损耗显微成像术”和“结构光照明显微术”;二是基于单分子定位的显微成像技术(Single-Molecule Localization Microscopy, SMLM)包括“随机光学重建显微术”(Stochastic Optical Reconstruction Microscopy, STORM)和“光激活定位显微术”(Photoactivated Localization Microscopy, PALM)等。SMLM作为当前分辨率最高的超分辨成像技术,受到广大科研工作者的青睐。本文对SMLM技术的原理、发展和应用等方面进行了全面的综述和讨论。
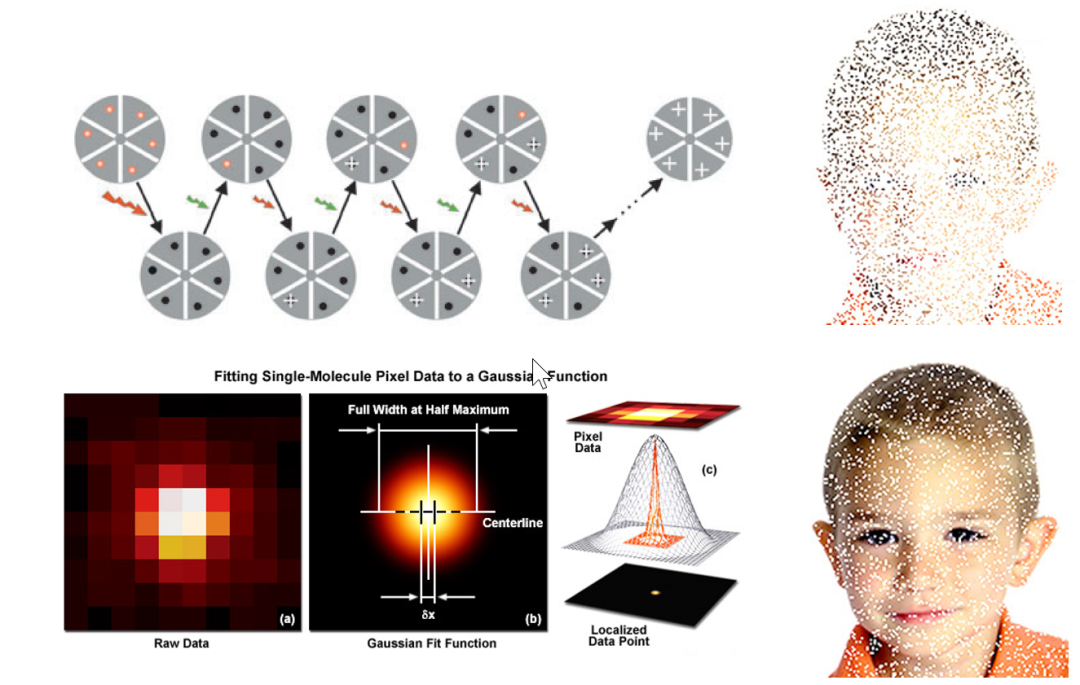
SMLM的核心思想是“闪烁”、“定位”与“重建”。“闪烁”目的是使衍射极限之内的荧光分子在同一时刻只有部分发光。“定位”指的是确定荧光分子的精确位置。单个点光源经过显微成像系统时,由于衍射现象,会在焦平面上形成模糊的光斑,被称为“艾里斑”,也叫做“点扩散函数”(Point Spread Function, PSF)。通过算法确定PSF的质心,即为“定位”。目前常用的定位算法主要包括最小二乘法和极大似然估计。“重建”则是将采集到的数万张含有荧光分子精准定位信息的图像叠加为一张SMLM超分辨图像。可以说SMLM通过采用极端“时间换空间”的策略,成为分辨率最高的超分辨成像技术。
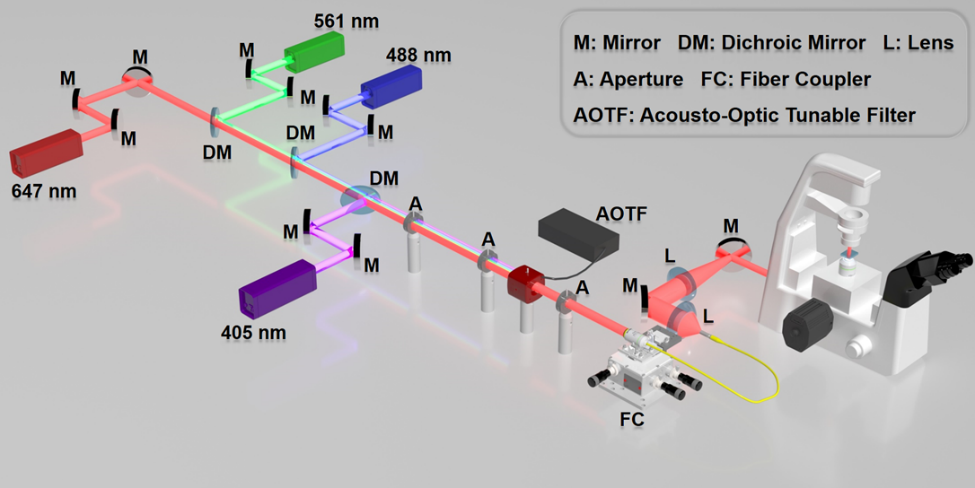
SMLM光学系统构建较为简单,不同颜色的激光通过反射镜和二向色镜进行合束并耦合进单模光纤,再将光纤传出的发散光通过透镜调整为准直光,最后通过凸透镜将光束汇聚到物镜后焦面上。为满足稀疏发光的要求,需要引入全内反射荧光成像系统,减少激发深度从而抑制背景荧光噪声。在探测器的选择上,一般选用高信噪比空间探测器,如EMCCD和sCMOS。声光可调谐滤波器(AOTF)可以在不改变激光器光强的条件下实现光强连续多通道调节。
由于分辨率极高、工作原理易懂等优点,庄小威教授提出的STORM和Eric Betzig教授提出的 PALM是目前应用最为广泛的SMLM技术。基于不同的闪烁机理,Sharonov等提出了纳米尺度点累积形貌成像(Points Accumulation for Imaging in Nanoscale Topography, PAINT)技术,后续Jungmann等提出了DNA-PAINT,也得到了较好发展和应用。
STORM与PALM的光路和工作原理均相同,只是荧光标记分子不同,STORM使用抗体偶联的商业探针,PALM使用荧光蛋白。两种方法没有本质的好坏,关键看应用场景,目前STORM应用相对较广泛。
PAINT不需要荧光分子稳定标记样品,而是通过多次采集记录自由扩散在溶液中的荧光探针与溶液中物体表面相互作用(碰撞后脱离或永久结合后漂白)发出的单分子荧光。如尼罗红(Nile Red),它在水中不发光,但在与脂质结合的疏水环境中发出强荧光。通过单分子定位算法获得每一帧图像中分子的位置,叠加后得到目标物的超分辨形貌特征。而DNA-PAINT是一种基于荧光分子标记的DNA寡核苷酸链动态结合和解离的单分子检测法,优势在于可以通过抗体特异性标记靶蛋白,且不依赖荧光探针本身的闪烁动力学特性,但存在背景荧光较强等问题。
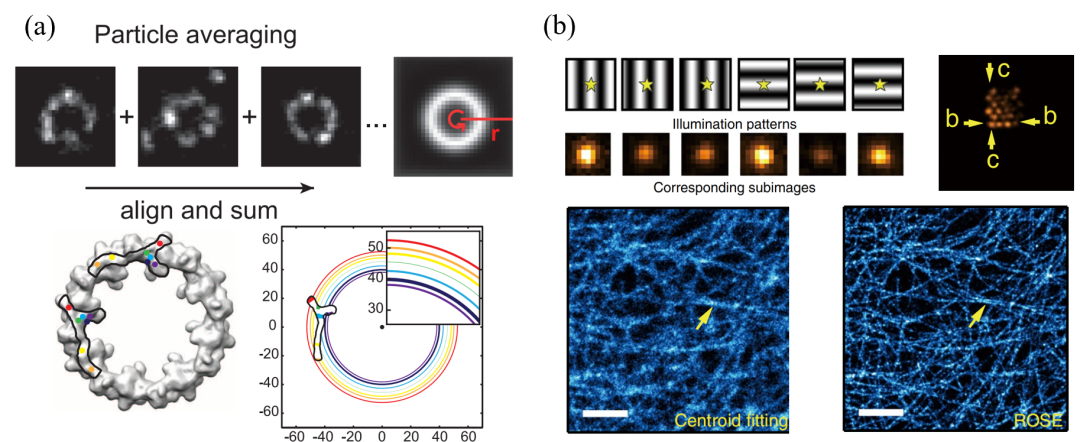
可从硬件、软件、软硬件相结合等方面提高SMLM横向分辨率。在硬件方面,2012年庄小威组构建出双物镜STORM成像系统,采集到的荧光光子数较单物镜系统提高两倍,等效提升了系统的数值孔径,将STORM的分辨率提高至10 nm。在软件方面,2013年Szymborska等基于粒子平均算法(Particle Averaging),将SMLM采集的数千个核孔复合物图像进行对齐求和得到平均图像,最终以小于1 nm的精度重构了核孔复合物经典的八重对称结构。在软、硬件结合方面,2019年中科院生物物理所纪伟等提出了一种新型单分子干涉定位超分辨成像方法,通过荧光分子强度与干涉条纹的相位关系来判断荧光分子的精确位置信息(类似GPS定位),以约3 nm的分辨率成功解析了5 nm间距的DNA折纸阵列。诺奖获得者Stefan Hell教授结合受激发射损耗显微成像术和SMLM提出一种最小光子流量(Minimal Photon Fluxes, MINFLUX)超分辨成像技术,可实现~1 nm的定位精度,~6 nm的成像精度,成为当前分辨率最高的单分子定位成像技术。
图3(a)粒子平均算法成像核孔[1]。(b)ROSE技术原理[2]
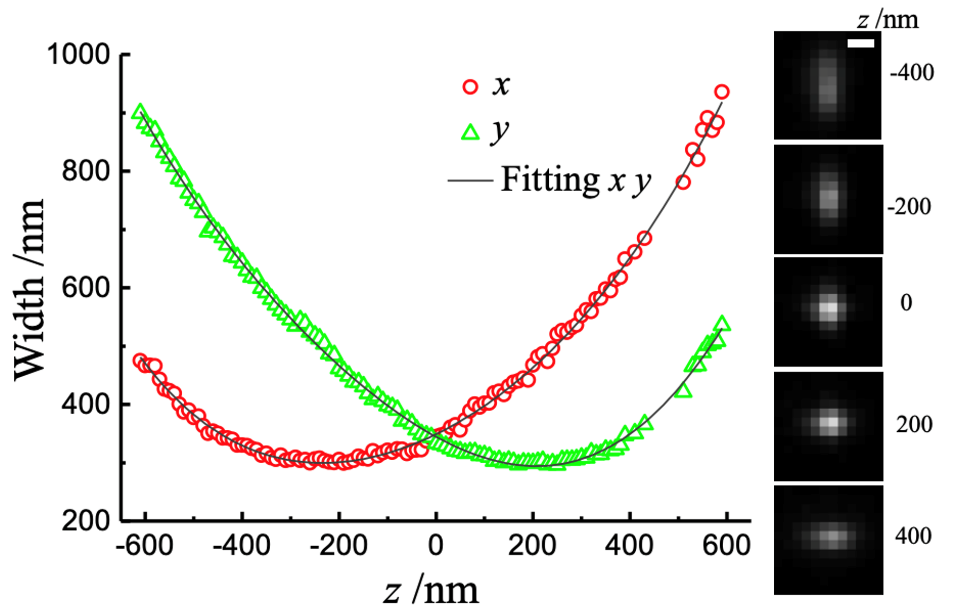
轴向分辨率方面,2008年庄小威组首先采用柱透镜像散方法,使PSF的横纵比随轴向深度变化而变化,实现了3D-STORM成像。该方法的成像深度约1 μm,轴向分辨率约50 nm,是目前最为常用的3D-SMLM成像方法。此外通过硬件与算法的改进,如双物镜荧光收集,双物镜荧光干涉测量(iPALM),新型PSF三维拟合定位算法等,将SMLM轴向分辨率提高至10 nm左右。
图4 基于柱透镜像散方法的3D-SMLM成像。荧光团的PSF沿x和y方向的宽度随z轴的变化及其拟合曲线(来源:潘雷霆实验室)
大视场SMLM有助于提高实验效率,增加数据可靠性。扩大成像视场可以考虑多个实验参数如物镜倍数(倍数越小视场越大)、激发光功率、相机芯片尺寸和相机采集速度。此外,大视场成像对图像的重建算法和计算机性能也提出了更高的要求。
基于全内反射照明的SMLM技术只能实施几百纳米轴向深度的成像,局限于样品表面信息的探测。z轴成像范围主要受到物镜的焦深、像差以及样品自身的折射率变化的影响,后者(尤其是厚样品)引入的像差会导致轴向定位精度和准确性下降。近年来基于PSF调制和激发光源改造,涌现了自弯曲点扩散函数法(Self –Bending Point Spread Function, SB-PSF)、全细胞4Pi单分子转换纳米显微法(Whole-cell 4Pi Single Molecule Switching Nanoscopy, W-4PiSMSN)、单分子斜面超分辨显微法(Single-Molecule oblique-plane Microscopy, obSTORM)等技术,使SMLM的轴向深度达到几十微米。
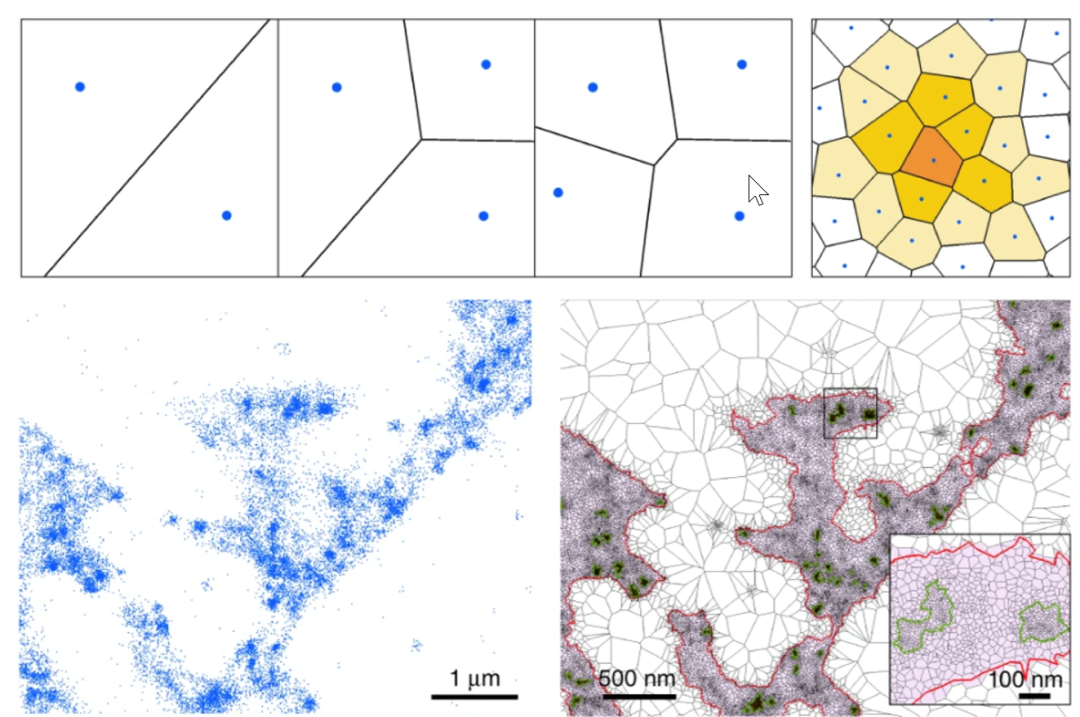
单分子定位图像是由众多高精度荧光定位点叠加组成,不仅可以给出目标物的超分辨形貌信息,还可以通过有效的数据提取和分析呈现出图片背后深层结构信息。目前针对SMLM数据已经发展出各种行之有效的分析方法,尤其是针对SMLM数据中形态较为多见的簇状结构的聚类分析,例如K函数法(Ripley’s K Function),关联函数法(Correlation Function),贝叶斯法(Bayesian Methods),DBSCAN(Density-Based Spatial Clustering of Applications with Noise)算法,FOCAL(Fast Optimized Cluster Algorithm for Localizations)算法,泰森多边形(Voronoï diagram)方法等。
图5 泰森多边形原理[3]。多边形由点与点之间的垂直平分线组成,可以从中提取面积,密度等信息,从而实现点簇解析。
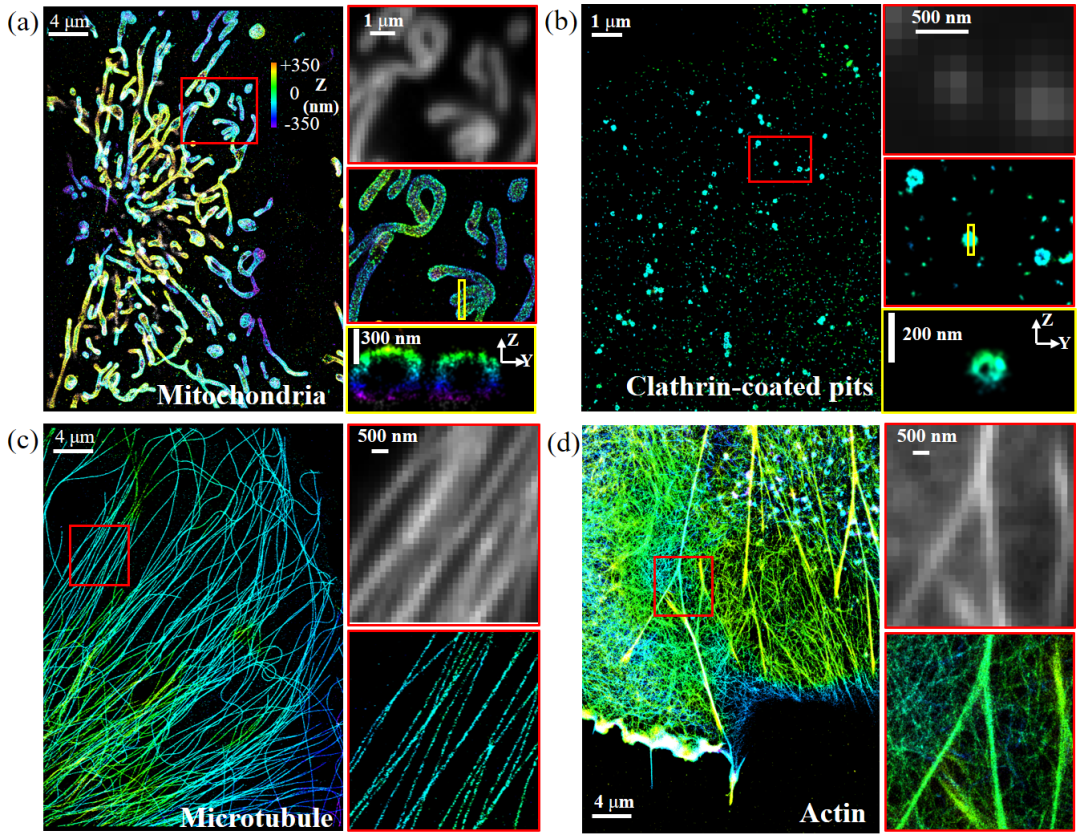
利用SMLM技术,陆续实现了细胞骨架、染色质、中心粒、核孔复合物、线粒体、内质网等诸多亚细胞结构的精细观察。
图6 STORM成像(a)线粒体、(b)网格蛋白小窝、(c)微管骨架和(d)微丝骨架。(来源:潘雷霆实验室)
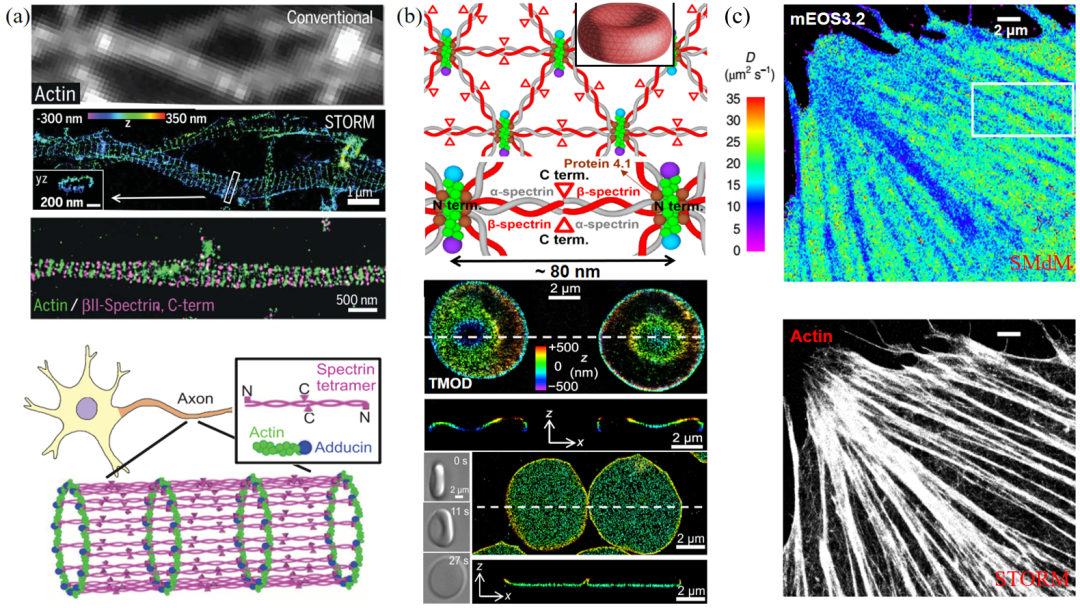
庄小威组基于双色STORM首次揭示出常规显微镜无法分辨的神经元轴突上肌动蛋白-帽蛋白复合物与血影蛋白交替排布形成间隔约180~190 nm的膜相关周期性骨架结构。潘雷霆等在近无损生理条件下对人红细胞骨架进行STORM超分辨成像,结合数据分析和理论建模,揭示出骨架核心组分血影蛋白生理状态长度约为80 nm,澄清了近40年的红细胞血影蛋白生理长度的疑问。加州大学伯克利分校Ke Xu组借助频闪技术开发了活细胞内单分子位移成像技术(Single-Molecule displacement Mapping, SMdM),实现了活细胞内游离的荧光蛋白分子自由扩散速率的超分辨成像。
图7 (a)STORM揭示神经细胞轴突周期性膜骨架结构[4]。(b)STORM揭示近生理条件下红细胞膜骨架组织特性[5]。(c)SMdM揭示胞质蛋白扩散特性[6]。
成像过程即为时空信息获取的博弈过程。不难看出,SMLM的工作方式原则上要求被定位成像的分子不能“动”,因此其在时间信息获取能力上存在先天固有缺陷。但也因为其单分子定位的原理属性,SMLM在空间信息获取能力拥有无可比拟的优势,是空间分辨率最高的超分辨成像技术。此外,SMLM在分辨率提升、多色成像、数据处理和分析等方面仍有诸多问题需深入研究。
设备使用方面,目前国内很多高校和科研院所陆续购买了SMLM设备,但由于老师学生甚至代理商,对仪器的工作原理、工作条件理解不深,样品制备流程不熟,工作经验缺乏,使得仪器使用效果欠缺,亟需通过不同形式的培训研讨等方式加强SMLM使用教育。期望本文能为SMLM使用者提供有益的启发和参考,帮助推进SMLM在生命科学中的有效应用。
[1] Szymborska A, De Marco A, Daigle N, et al. Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science, 2013, 341(6146): 655-658.
[2] Gu L, Li Y, Zhang S, et al. Molecular resolution imaging by repetitive optical selective exposure. Nature Methods, 2019, 16(11): 1114-1118.
[3] Levet F, Hosy E, Kechkar A, et al. SR-Tesseler: a method to segment and quantify localization-based super-resolution microscopy data[J]. Nature Methods, 2015, 12(11): 1065-1071.
[4] Xu K, Zhong G, Zhuang X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science, 2013, 339(6118): 452-456.
[5] Pan L, Yan R, Li W, et al. Super-resolution microscopy reveals the native ultrastructure of the erythrocyte cytoskeleton. Cell Reports, 2018, 22(5): 1151-1158.
[6] Xiang L, Chen K, Yan R, et al. Single-molecule displacement mapping unveils nanoscale heterogeneities in intracellular diffusivity. Nature Methods, 2020, 17(5): 524-530.
课题组依托于南开大学弱光非线性光子学教育部重点实验室建设,主要从事生物医学光学方面交叉探索研究,包括超分辨光学成像及应用、细胞光刻图案化操控、光生物学效应等。
潘雷霆,南开大学物理科学学院教授、博导,药物化学生物学国家重点实验室兼聘PI。主要从事纳微尺度细胞成像与操控研究。2015年入选天津市“131”创新型人才培养工程,2018年入选“南开大学百名青年学科带头人培养计划”。作为主持人承担国家自然科学基金3项、教育部新教师基金1项和天津市自然科学基金1项。以第一或通讯作者在Advanced Science, Cell Reports, Biophysical Journal等杂志发表SCI/EI收录论文30余篇。中国微循环学会血液治疗专业委员会常委、中国光学学会生物医学光子学专业委员会青年委员、中国生物物理学会自由基生物学与自由基医学分会青年委员。British Journal of Pharmacology、Photonics Research、Optics Letters、Frontiers in Chemistry和《光学学报》等多个领域杂志审稿人。